Phaseolus lunatus (PROTA)
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Céréale / légume sec | |
| Médicinal | |
| Fourrage | |
| Auxiliaire | |
| Sécurité alimentaire | |
| Changement climatique | |
- Protologue: Sp. pl. 2 : 724 (1753).
- Famille: Papilionaceae (Leguminosae - Papilionoideae, Fabaceae)
- Nombre de chromosomes: 2n = 22
Noms vernaculaires
- Haricot de Lima, pois du Cap, pois souche, pois savon (Fr).
- Lima bean, butter bean, Madagascar bean (En).
- Feijão de Lima, feijão favona, feijão espadinho (Po).
- Mfiwi (Sw).
Origine et répartition géographique
Le haricot de Lima est d’origine néotropicale, avec au moins deux centres de domestication : l’Amérique centrale (Mexique, Guatemala) pour les types à petites graines et l’Amérique du Sud (essentiellement le Pérou) pour les types à grosses graines. Cette distinction coïncide avec une classification en 2 types (mésoaméricain et andin) établie sur la base des caractères morphologiques, écologiques, protéiniques et moléculaires. Les formes sauvages et cultivées de la même race sont regroupées. Les populations sauvages andines ont une répartition géographique très restreinte (l’Equateur et le nord du Pérou). Les types sauvages mésoaméricains vont du Mexique à l’Argentine, en passant par le flanc est des Andes. Des découvertes récentes ont conduit à former l’hypothèse qu’il existe 3 centres primaires de diversité génétique, dont 2 sont également des centres de domestication : un centre de diversité génétique et de domestication sur le versant occidental des Andes au sud de l’Equateur et au nord du Pérou ; un centre de diversité génétique et de domestication en Amérique centrale ; et un centre de diversité génétique dans la région qui couvre le nord du Pérou, le nord de la Colombie, le nord de l’Equateur et l’ouest du Venezuela.
A l’époque post-colombienne, le haricot de Lima s’est répandu sur la totalité du continent américain. Les Espagnols ont introduit les graines aux Philippines, via le Pacifique, d’où elles se sont diffusées dans d’autres régions d’Asie, principalement à Java et au Myanmar (Birmanie) ainsi qu’à l’île Maurice. C’est le commerce des esclaves qui entraina l’introduction du haricot de Lima depuis le Brésil vers Afrique, notamment dans les régions de l’ouest et du centre. Certains types à grosses graines originaires de la côte péruvienne se sont diffusés au sud-ouest de Madagascar et au sud de la Californie. Aujourd’hui, le haricot de Lima est cultivé à travers toute l’Afrique tropicale et dans le reste des tropiques, où il s’est souvent naturalisé.
Usages
Le haricot de Lima est cultivé avant tout pour ses graines immatures ou sèches ; en Afrique tropicale, celles-ci se mangent généralement cuites à l’eau, à l’huile ou au four. Au Nigeria, on les cuisine également avec du maïs, du riz ou de l’igname et elles servent à préparer des soupes et des ragoûts particuliers. Les Yorubas en font des bouillies, des desserts et des gâteaux. Dans des pays comme le Ghana et le Malawi, les graines vertes immatures, les jeunes gousses et les feuilles se mangent en légume. Aux Etats-Unis, le haricot de Lima frais ou sec est transformé de façon industrielle, appertisé ou congelé. Les germes et les jeunes plantes se cuisinent et se consomment dans de nombreux pays asiatiques.
Les graines s’emploient parfois comme fourrage mais, crues, elles peuvent provoquer des empoisonnements à l’acide cyanhydrique. Les feuilles et les tiges peuvent être transformées en foin ou en ensilage. Au Sénégal et en R.D. du Congo, le jus des feuilles sert à préparer des instillations nasales contre les maux de tête et des gouttes contre les otites. Au Nigeria, les graines sont réduites en poudre et frottées dans de petites coupures effectuées sur des tumeurs et des abcès pour favoriser leur suppuration. En médecine traditionnelle asiatique, graines et feuilles sont appréciées pour leurs propriétés astringentes ; elles servent d’aliment en cas de fièvre. Le haricot de Lima a été cultivé comme plante de couverture et comme engrais vert.
Production et commerce international
Les statistiques de production de haricot de Lima qui proviennent de nombreuses régions tropicales sont fragmentaires, et souvent amalgamées avec celles d’autres légumes secs. Les Etats-Unis sont le plus gros producteur, avec près de 21 000 ha cultivés (principalement en Californie, au Delaware, au Maryland et au Wisconsin) et une production de haricots (surtout frais) d’environ 70 000 t en 1995. En seconde position vient Madagascar, avec une superficie cultivée qui varie entre 3000 et 19 000 ha (principalement dans les plaines inondables de la région côtière semi-aride située dans le sud-ouest) et une production de graines sèches d’environ 8000 t constituées presque exclusivement de types à grosses graines blanches. Le Pérou occupe la troisième place, avec 5000–5500 t de graines sèches, produites sur 5000–6000 ha. Dans les autres pays, le haricot de Lima se cultive surtout en jardins familiaux ou comme culture associée, mais il n’existe pas d’estimations sur la superficie ou la production. En Afrique, la superficie pour cette culture, pratiquée dans les zones tropicales subhumides et humides (notamment le Sierra Leone, le Libéria, la Côte d’Ivoire, le Ghana, le Nigeria et la R.D. du Congo) a été évaluée pour les années 1980 à 120 000–200 000 ha, ce qui représentait une production totale de 50 000–100 000 t par an. On ne dispose d’aucune statistique relative aux échanges commerciaux.
Propriétés
La composition des graines sèches crues, par 100 g de partie comestible est de : eau 11,6 g, énergie 1214 kJ (290 kcal), protéines 19,1 g, lipides 1,7 g, glucides 52,9 g, fibres alimentaires 19,4 g, Ca 85 mg, Mg 190 mg, P 320 mg, Fe 5,9 mg, Zn 2,8 mg, carotène : traces, thiamine 0,45 mg, riboflavine 0,13 mg, niacine 2,5 mg, vitamine B6 0,51 mg et acide ascorbique : traces (Holland, Unwin & Buss, 1991). La composition en acides aminés essentiels par 100 g de graines sèches crues, est de : tryptophane 180 mg, lysine 1440 mg, méthionine 280 mg, phénylalanine 1160 mg, thréonine 800 mg, valine 980 mg, leucine 1560 mg, isoleucine 950 mg (Paul, Southgate & Russell, 1980). Comme chez les autres légumes secs, les principaux acides aminés limitants sont la méthionine et la cystine. Parmi les facteurs antimétaboliques, il faut citer les inhibiteurs de protéase, les lectines et les glucosides cyanogènes (linamarine ou phaséolunatine). Ces derniers s’accompagnent d’un enzyme, la linamarase, qui peut hydrolyser les glucosides en un sucre et un aglycone, lequel se fractionne à son tour en acétone et en acide cyanhydrique (HCN). L’hydrolyse intervient rapidement lorsqu’on fait cuire les graines à l’eau après trempage ; ensuite la plus grande partie de l’HCN s’évapore. La linamarine et la linamarase sont sensibles à la chaleur mais inactivées à d’autres températures : 140°C pour le glucoside et 80°C pour l’enzyme. Si l’inactivation des enzymes a lieu avant la fin de l’hydrolyse, il se peut que le glucoside résiduel se dissolve dans l’organisme humain sous l’influence des enzymes sécrétées par la microflore intestinale et provoque un empoisonnement. La teneur en HCN est nettement plus élevée chez les types sauvages ( 2000–2400 ppm) que chez les types cultivés (100–120 ppm). Un trempage à l’eau des graines pendant une nuit élimine facilement la toxicité apparente ; ceci s’explique par la libération de HCN pendant le processus. Au Nigeria, il faut cuire les graines sèches pendant 1–1,5 heures. Au Malawi, on a noté des temps de cuisson de 2–2,5 heures pour les graines sèches non trempées, et de 1,5–2 heures pour les graines sèches trempées.
Par 100 g de partie comestible, les gousses vertes contiennent 1,3 g de protéines et les feuilles vertes 0,6 g. Les graines immatures de haricot de Lima contiennent, par 100 g de partie comestible : eau 66,3 g, protéines 8,3 g, lipides 0,7 g, glucides 23,1 g, fibres 1,0 g, Ca 28 mg, P 111 mg, Fe 2,6 mg, vitamine A 65 UI, thiamine 0,15 mg, riboflavine 0,10 mg, niacine 1,20 mg et acide ascorbique 27,0 mg (Kay, 1979). L’ensilage de haricot de Lima contient 27,3% de matière sèche, 3,3% de protéines, 2,1% de protéines assimilables et 14,2% de nutriments assimilables.
Description
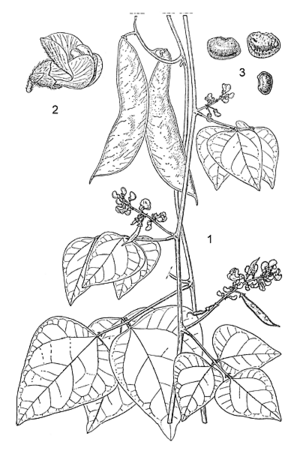
- Plante herbacée annuelle ou vivace, grimpante, rampante ou plus ou moins buissonnante, à tiges glabres ou pubescentes atteignant 4,5(–8) m de long ; racines fines ou renflées, atteignant 2 m de profondeur.
- Feuilles alternes, 3-foliolées ; stipules ovales à lancéolées, atteignant 2–4 mm de long ; pétiole de 1,5–19 cm de long, rachis de 0,5–5(–8) cm de long ; stipelles de 1–2 mm de long ; folioles ovales, de 3–19,5 cm × 1–11 cm, aiguës ou acuminées, légèrement pubescentes ou glabres.
- Inflorescence : grappe axillaire ou panicule atteignant 15 (–40) cm de long, avec de nombreux nœuds, à fleurs peu nombreuses à nombreuses.
- Fleurs bisexuées, papilionacées ; pédicelle de 5–10 mm de long ; calice campanulé, de 2,5–3,5 mm de long, pubérulent, les 2 lobes supérieurs réunis en un seul, les 3 lobes inférieurs largement triangulaires ; corolle de 7–10 mm de large, étendard cucullé, de 5–7 mm × 5–10 mm, blanc, vert pâle ou rose violet, ailes spatulées à obovales, de 7–10 mm de long, blanches ou violettes, carène brusquement recourbée, blanche ou vert pâle ; étamines 10, dont 9 soudées et 1 libre ; ovaire supère, d’environ 3 mm de long, finement poilu, style pourvu d’une spirale terminale et d’un collet de poils sous le stigmate.
- Fruit : gousse oblongue de (4,5–)5–10,5(–13) cm × 1–2(–3) cm, comprimée, généralement courbe, pourvue d’un bec, glabre ou pubescente, contenant 2–4(–5) graines.
- Graines réniformes à rhomboïdes ou globuleuses, de 8–11 mm × 6–7 mm, blanches, vertes, jaunes, brunes, rouges, violettes, noires ou diversement marbrées, souvent à lignes transversales qui rayonnent à partir du hile.
- Plantule à germination épigée ; première paire de feuilles simple et opposée.
Autres données botaniques
Le genre Phaseolus comprend environ 50 espèces, dont la plupart se trouvent dans les Amériques. Les formes sauvages et cultivées de Phaseolus lunatus ont été distinguées comme var. silvester Baudet et var. lunatus, respectivement. On a distingué certains groupes de cultivars au sein des formes cultivées : le Groupe Sieva aux graines aplaties de taille moyenne, le Groupe Potato aux graines petites et globuleuses et le Groupe Big Lima aux grandes graines aplaties. Les formes sauvages originaires des Andes semblent les plus proches des formes cultivées.
Au Malawi, on distingue et on nomme les types de haricot de Lima en fonction de la taille et de la forme des graines, par ex. le “mayemba” (grosses graines mouchetées de blanc ou de noir, légèrement amères, tégument moyennement dur), le “butter” ou “Madagascar” (grosses graines blanches aplaties, savoureuses, tégument moux et sans goût), le “moki” (petites graines blanches aplaties, savoureuses, tégument moyennement dur) et “pebugale” (forme de graine variable, de couleur rose pâle, mouchetée de rouge, légèrement amère et à tégument dur).
Croissance et développement
La germination du haricot de Lima a lieu 4–10 jours après le semis. Au bout d’un mois, la croissance végétative s’accélère. Lors d’un semis en conditions de jours courts, les fleurs apparaissent après 35–70 jours et les gousses mûres après 80–120 jours. Le haricot de Lima cultivé possède deux types de croissance distincts : un port indéterminé (prostré ou grimpant, à floraison axillaire uniquement) et l’autre pseudo-déterminé (plantes naines ou buissonnantes, à floraison terminale et axillaire). Le cycle végétatif des types à croissance pseudo-déterminée est plus court que celui des types à croissance indéterminée. Les cultivars buissonnants les plus précoces mûrissent en 90 jours, tandis que les types grimpants ont besoin de 6–9 mois. Chez les types grimpants, la floraison et la fructification peuvent se prolonger pendant toute la saison des pluies. Le mode de croissance des types vivaces sauvages est toujours indéterminé.
Le pollen et le stigmate mûrissent simultanément et en voisinage immédiat à l’intérieur du bouton non ouvert, ce qui favorise l’autofécondation. Mais la pollinisation croisée est fréquente également. Une pression exercée par les insectes sur les ailes des fleurs ouvertes complètement force le stigmate et le style à dépasser de la carène. Ainsi exposé, le stigmate demeure réceptif au pollen pendant plusieurs heures. Les abeilles butinent à la fois le pollen et le nectar. Au champ, 75–85% des boutons, des fleurs et des jeunes gousses tombent. Les inflorescences à floraison précoce sont plus productives que les tardives, et les nœuds situés à la base de l’inflorescence sont souvent plus fructifères que ceux du haut. La fructification continue jusqu’à ce qu’un “seuil de capacité” soit atteint ; à ce moment-là, les structures reproductives restantes tombent. Le haricot de Lima peut fixer l’azote par symbiose avec des bactéries Bradyrhizobium.
Ecologie
Particulièrement bien adapté aux climats tropicaux humides et subhumides de basse altitude, le haricot de Lima se cultive dans des conditions écologiques très diverses. On le trouve aussi bien dans des zones chaudes tempérées que des régions tropicales arides et semi-arides. On le rencontre depuis le niveau de la mer jusqu’au-dessus de 2000 m. Il comprend des types insensibles à la photopériode qui fleurissent même lorsque la longueur du jour atteint 18 heures, et des types à jours courts qui ont besoin d’une longueur du jour ne dépassant pas 11–12,5 heures pour l’initiation florale. Les températures optimales sont de 16–27°C ; le gel n’est pas toléré. Il faut des précipitations de 900–1500 mm par an en moyenne, mais une fois établie, la culture supporte des précipitations faibles, de l’ordre de 500–600 mm. Certains types ont la réputation de très bien résister à la sécheresse en raison de leur système racinaire profond et bien développé. Le haricot de Lima préfère les sols bien aérés et bien drainés avec un pH de 6, 0–6,8. Mais certains cultivars supportent les sols acides avec un pH de seulement 4,4.
Multiplication et plantation
Le haricot de Lima est reproduit par graines. Le poids des graines varie de 30 à 300 g par 100 graines. Les types buissonnants sont généralement espacés de 20–30 cm sur la ligne et de 60–100 cm entre les lignes, les types grimpants pouvant être plantés quant à eux sur des buttes espacées de 90–200 cm. Le haricot de Lima peut se mettre en place par groupes de 3–4 plantes, espacées d’au moins 1 m. La densité de semis se situe dans une fourchette de 55–80 kg/ha pour les cultivars à petites graines et de 130–160 kg/ha pour les types à grandes graines. La densité de plantation dans le sud-ouest de Madagascar est de (500–)2100(–4500) poquets par ha, et de 3–5 graines par poquet.
Dans les régions tropicales plus humides, le haricot de Lima est la plupart du temps cultivé dans les jardins familiaux ou en association avec des céréales (maïs, sorgho), des plantes à racines ou à tubercules (igname, manioc) ou d’autres plantes (comme le bananier, l’arachide ou la canne à sucre). La culture pure se pratique surtout dans les régions plus sèches (Madagascar, Pérou). Dans le cas d’une culture associée, il est fréquent de disposer les graines sur la même butte que la plante qu’elles accompagnent.
Gestion
Le désherbage est nécessaire au début de la croissance du haricot de Lima. En Afrique, il s’effectue habituellement jusqu’à 3 fois. Dans les régions humides, les types grimpants sont tuteurés. Sans ces tuteurs, les plantes ont tendance à moins produire parce qu’elles peuvent moins bien étaler leur feuillage, et la qualité des graines est inférieure parce que les gousses reposent parfois sur le sol. Dans certains endroits d’Afrique de l’Ouest, où le haricot de Lima est cultivé en association avec du maïs ou du sorgho, ces céréales procurent un support aux types grimpants. Le haricot de Lima peut aussi se planter après une culture d’igname ; dans ce cas, les mêmes tuteurs servent de soutien. Dans les zones de climat sec (Madagascar, Californie et Pérou), le haricot de Lima peut être cultivé sans tuteurs et on l’arrose 2–4 fois avant sa maturité. Dans la partie sud-ouest de Madagascar, ce haricot se plante sur les sols alluviaux, sur buttes ou billons, lors de la décrue d’une rivière proche, ou bien avec irrigation depuis la rivière. On n’applique généralement pas d’engrais sous les tropiques. Sinon, l’engrais est souvent apporté à la plantation, en bandes sous les graines ou à côté de celles-ci. Des compléments azotés et phosphorés peuvent être épandus au début de l’apparition des boutons floraux et pendant la formation des fruits. Le haricot de Lima peut être installé à la suite d’une culture qui a reçu de bons apports en engrais, profitant ainsi des engrais résiduels, notamment phosphorés.
Maladies et ravageurs
Sous les tropiques, les maladies les plus graves du haricot de Lima sont le rhizoctone Rhizoctonia solani, la maladie du pied du haricot (Fusarium solani), l’anthracnose (Colletotrichum spp.), le mildiou (Phytophthora phaseoli), la graisse bactérienne (Xanthomonas campestris pv. phaseoli) et deux maladies virales : le virus de la mosaïque dorée du haricot de Lima (LGMV) transmis par aleurodes (Bemisia sp.) et le virus de la marbrure verte du haricot de Lima (LBGrMV) transmis par pucerons. Il est recommandé d’avoir recours à des fongicides pour lutter contre les maladies fongiques. Pour la graisse bactérienne, les mesures de lutte conseillées sont l’utilisation de semences exemptes de maladies et la rotation des cultures.
Les nématodes à galles (principalement Meloidogyne incognita) peuvent faire chuter considérablement le rendement. Mais une rotation avec des céréales peut réduire la population des nématodes présents dans le sol. La coccinelle mexicaine du haricot (Epilachna varivestis), les pucerons (principalement Aphis craccivora), une cicadelle (Empoasca dolichi), le thrips des fleurs (Megalurothrips sjostedti), les foreurs de gousses (Maruca vitrata, Cydia sp. et Etiella sp.), ainsi que les bruches (Callosobruchus, Acanthoscelides et Zabrotes spp.) sont des ravageurs importants. Il est recommandé d’utiliser contre eux des moyens de lutte chimique (par ex. de l’endosulfan).
Récolte
Les gousses vertes et mûres des types grimpants du haricot de Lima se ramassent généralement à la main sur une longue période (4–6 semaines). Dans les régions chaudes (Madagascar), on coupe les plantes entières et on les fait sécher au champ avant d’en ôter les gousses et de donner les tiges à manger au bétail. Avec les cultivars érigés dont la maturité est homogène et dont les gousses se tiennent bien au-dessus de la surface du sol, une récolte mécanisée est envisageable.
Rendement
Sous les tropiques, les rendements en graines sèches de haricot de Lima vont de 200–600 kg/ha en culture associée à 1000–1500 kg/ha en culture pure. Dans le sud-ouest de Madagascar, les rendements sont de (50–)400(–950) kg/ha. Dans des essais, les rendements en graines sèches de cultures pures ont atteint 2000–2500 kg/ha pour les types buissonnants et 3000–4000 kg/ha pour les types grimpants. A Madagascar, on a obtenu des rendements de 15 t par ha de matière fraîche en culture fourragère.
Traitement après récolte
Les gousses de haricot de Lima sont habituellement battues manuellement et les graines sont nettoyées et triées. Le battage doit être effectué avec soin, car les graines, fragiles, s’endommagent facilement. Dans nombre de pays tropicaux, les graines se conservent parfois dans des jarres ou des paniers, et on les recouvre d’une couche de sable ou de cendres pour les protéger des infestations de bruches.
Ressources génétiques
Il existe un véritable risque de perte de diversité génétique pour le haricot de Lima, autant dans ses centres primaires de diversité (en Amérique latine) que dans les centres secondaires où se trouvent les types cultivés (l’Afrique et une partie de l’Asie). Plus de 2600 entrées de haricot de Lima sont disponibles dans les collections du CIAT (Centre international d’agriculture tropicale) de Cali (Colombie) ; les graines proviennent principalement d’Amérique du Sud et centrale, d’Afrique de l’Ouest (surtout du Ghana et du Nigeria), d’Afrique centrale et de l’Est, de Madagascar, d’Inde, des Philippines et du Myanmar. Les types sauvages et adventices représentent 3–5% de la collection totale. Parmi les types cultivés, deux groupes prédominent : le Groupe Sieva et le Groupe Potato. Les entrées du Groupe Big Lima viennent de quelques régions restreintes, comme la région des Andes en Amérique du Sud ou le désert côtier du Pérou. D’après l’IPGRI, il existe d’autres grandes collections de haricots de Lima en Indonésie (Research and Development Centre for Biology (RDCB), Bogor, 3850 entrées), aux Etats-Unis (Regional Plant Introduction Station, Washington State University, Pullman, Washington, 1060 entrées), au Brésil (Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), Brasilia, 980 entrées), aux Philippines (National Plant Genetic Resources Laboratory, University of the Philippines Los Baños (UPLB), College, Laguna, 780 entrées) et au Costa Rica (Escuela de Biología, Universidad de Costa Rica (UCR), San Pedro de Montes de Oca, 400 entrées). En Afrique tropicale, de petites collections de haricot de Lima existent au Ghana (Plant Genetic Resources Centre, Crops Research Institute, Bunso, 40 entrées ; à l’université du Ghana, Accra, 8 entrées), au Togo (Institut de recherches agronomiques tropicales et des cultures vivrières, Lomé, 36 entrées ; Direction de la recherche agronomique (DRA), Lomé, 17 entrées), en Guinée (Programme de conservation des ressources phytogénétiques, Institut de recherche, Conakry, 34 entrées), au Sénégal (Institut sénégalais de recherches agricoles (ISRA), Dakar, 23 entrées), au Nigeria (International Institute of Tropical Agriculture, Ibadan, 15 entrées), au Kenya (National Genebank of Kenya, Crop Plant Genetic Resources Centre, KARI, Kikuyu, 12 entrées) et en Ethiopie (Institut international de recherche sur le bétail (ILRI), Addis Abéba, 2 entrées). Le Jardin botanique national de Belgique, à Meise, a été désigné par l’IPGRI pour être le conservatoire de base des Phaseolus sauvages, qui comprend des entrées sauvages de Phaseolus lunatus et des espèces apparentées.
Sélection
L’évaluation et l’amélioration génétique à partir des collections internationales ont été menées à l’IITA (à Ibadan, au Nigeria) entre 1973 et 1980, et ultérieurement au CIAT (à Cali, en Colombie) entre 1980 et 1992, les objectifs généraux étant d’augmenter le rendement en graines sèches, d’améliorer la résistance aux ravageurs et aux maladies et d’améliorer la qualité nutritionnelle des graines. Des programmes d’amélioration du haricot de Lima à petite échelle à l’aide de collections locales sont menées au Ghana, au Nigeria, en R.D. du Congo, en Zambie et à Madagascar. Les méthodes adoptées sont la sélection de lignées pures et la sélection massale de populations ; les systèmes de culture visés comprennent aussi bien la culture pure que les cultures associées. Un port dressé, la résistance à la verse et au rhizoctone constituent les critères essentiels dans l’amélioration des types buissonnants pseudo-déterminés. La précocité, l’insensibilité à la photopériode, la résistance au virus de la mosaïque dorée du haricot de Lima et l’adaptabilité à la culture associée sont recherchées chez les types grimpants. Un certain nombre de types prometteurs ont été identifiés dans les régions tropicales humides parmi les formes grimpantes. Un vaste pool génique secondaire est disponible pour l’amélioration et les espèces sauvages suivantes ont été croisées avec succès avec le haricot de Lima : Phaseolus jaliscanus Piper, Phaseolus maculatus Scheele, Phaseolus polystachyus (L.) Britton, Sterns & Poggenb. et Phaseolus salicifolius Piper. L’introgression de gènes utiles des taxons sauvages (par ex. la résistance à la mosaïque dorée du haricot de Lima) a été observée dans du matériel de sélection issu de croisements interspécifiques. De nombreux cultivars commerciaux de haricot de Lima ont été obtenus aux Etats-Unis.
Perspectives
En raison de son fort potentiel de rendement, son enracinement profond et sa tolérance à la sécheresse, le haricot de Lima offre de bonnes perspectives en Afrique tropicale. Des études préliminaires ont fait ressortir le fort potentiel et la grande diversité des ressources génétiques de Phaseolus lunatus. Des progrès ont été accomplis dans la sélection, surtout dans les régions situées hors de son centre d’origine (par exemple sous les climats tempérés des Etats-Unis). Mais beaucoup reste à faire dans de nombreuses régions des tropiques, notamment pour mettre au point des cultivars plus stables et plus productifs destinés aux zones tropicales humides, subhumides et semi-arides. Les efforts de sélection doivent porter sur les deux modes de croissance indépendamment l’un de l’autre. Les types grimpants indéterminés ont généralement des rendements en graines sèches élevés mais instables et nécessitent un système de tuteurage onéreux. Dans les régions tropicales, ces types sont principalement cultivés en association avec des céréales ou des plantes à racines ou à tubercules. Et jusqu’à maintenant, on a sélectionné peu de génotypes adaptés à la culture associée, ce qui explique la médiocre performance du haricot de Lima grimpant dans ces systèmes, malgré son fort potentiel. Ce sont les types buissonnants pseudo-déterminés qui sont les plus appropriés à la culture pure et aux systèmes d’agriculture intensive. Mais les résultats sont décourageants, surtout dans les tropiques humides, en raison de l’architecture défavorable de la plante (ramification abondante, gousses situées dans le feuillage et verse sévère) et d’une grande sensibilité aux maladies. La clé du succès serait de mettre au point des types buissonnants indéterminés dotés de plusieurs caractères leur conférant une adaptation large, telles que l’enracinement profond, la tolérance à la sécheresse, la résistance aux maladies et un fort potentiel de rendement. La recherche doit se consacrer en priorité à la pleine exploitation de la grande variation génétique disponible dans le pool génique primaire d’origine mésoaméricaine et andine. Mais l’exploitation de pools géniques exotiques et la sélection parmi les populations interspécifiques n’est pas à négliger, si l’on veut relever le défi d’atteindre des rendements élevés et stables sous les tropiques humides.
Références principales
- Baudoin, J.P., 1989. Phaseolus lunatus L. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 57–60.
- Baudoin, J.P., 1991. La culture et l’amélioration de la légumineuse alimentaire Phaseolus lunatus L. en zones tropicales. CTA (Centre Technique de Coopération Agricole et Rurale, Ede, Pays-Bas) et FSAGx (Faculté des Sciences Agronomiques de Gembloux, Belgique), Gembloux, Belgium. 209 pp.
- Baudoin, J.P., 2002. Amélioration des plantes protéagineuses. Les légumineuses alimentaires (Phaseolus, Vigna, Cajanus, etc.). In: Demol, J. (Coordinator). Amélioration des plantes. Application aux principales espèces cultivées en régions tropicales. Les Presses Agronomiques de Gembloux, Gembloux, Belgium. pp. 351–392.
- Baudoin, J.P. & Mergeai, G., 2001. Lima bean. In: Raemaekers, R.H. (Editor). Crop production in tropical Africa. DGIC (Directorate General for International Co-operation), Ministry of Foreign Affairs, External Trade and International Co-operation, Brussels, Belgium. pp. 355–360.
- Burkill, H.M., 1995. The useful plants of West Tropical Africa. 2nd Edition. Volume 3, Families J–L. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 857 pp.
- Fofana, B., du Jardin, P. & Baudoin, J.P., 2001. Genetic diversity in the Lima bean (Phaseolus lunatus L.) as revealed by chloroplast DNA (cpDNA) variations. Genetic Resources and Crop Evolution 48(5): 437–445.
- Freytag, G. & Debouck, D.G., 2002. Taxonomy, distribution and ecology of the genus Phaseolus (Leguminosae - Papilionoideae) in North America, Mexico and Central America. Botanical Institute of Texas, Fort Worth, Texas, United States. 300 pp.
- Kay, D.E., 1979. Food legumes. Crops and Product Digest No 3. Tropical Products Institute, London, United Kingdom. 435 pp.
- Lyman, J.P., Baudoin, J.P. & Hidalgo, R., 1985. Lima bean (Phaseolus lunatus L.). In: Summerfield, R.J. & Roberts, E.H. (Editors). Grain legume crops. Collins, London, United Kingdom. pp. 477–519.
- Rollin, D., 1997. Quelles améliorations pour les systèmes de culture du sud-ouest malgache? Agriculture et Développement 16: 57–72.
Autres références
- Baudet, J.C., 1977. The taxonomic status of the cultivated types of Lima bean (Phaseolus lunatus L.). Tropical Grain Legume Bulletin 7: 29–30.
- Baudoin, J.P., 1988. Genetic resources, domestication and evolution of Lima bean, Phaseolus lunatus. In: Gepts, P. (Editor). Genetic resources, domestication and evolution of Phaseolus beans. Kluwer Academic Publishers, Dordrecht, Netherlands. pp. 393–407.
- Baudoin, J.P., 1993. Lima bean Phaseolus lunatus L. In: Kalloo, G. & Bergh, B.O. (Editors). Genetic improvement of vegetable crops. Pergamon Press, Oxford, United Kingdom. pp. 391–403.
- Berhaut, J., 1976. Flore illustrée du Sénégal. Dicotylédones. Volume 5. Légumineuses Papilionacées. Gouvernement du Sénégal, Ministère du Développement Rural et de l’Hydraulique, Direction des Eaux et Forêts, Dakar, Senegal. 658 pp.
- Duke, J.A., 1981. Handbook of legumes of world economic importance. Plenum Press, New York, United States, and London, United Kingdom. 345 pp.
- Ezueh, M.I., 1977. The cultivation and utilization of minor food legumes in Nigeria. Tropical Grain Legume Bulletin 10: 28–32.
- Fofana, B., Baudoin, J.P., Vekemans, X., Debouck, D.G. & du Jardin, P., 1999. Molecular evidence for an Andean origin and a secondary gene pool for the Lima bean (Phaseolus lunatus L.) using chloroplast DNA. Theoretical and Applied Genetics 98(2): 202–212.
- Gillett, J.B., Polhill, R.M., Verdcourt, B., Schubert, B.G., Milne-Redhead, E., & Brummitt, R.K., 1971. Leguminosae (Parts 3–4), subfamily Papilionoideae (1–2). In: Milne-Redhead, E. & Polhill, R.M. (Editors). Flora of Tropical East Africa. Crown Agents for Oversea Governments and Administrations, London, United Kingdom. 1108 pp.
- Hauman, L., Cronquist, A., Boutique, R., Majot-Rochez, R., Duvigneaud, P., Robyns, W. & Wilczek, R., 1954. Papilionaceae (troisième partie). In: Robyns, W., Staner, P., Demaret, F., Germain, R., Gilbert, G., Hauman, L., Homès, M., Jurion, F., Lebrun, J., Vanden Abeele, M. & Boutique, R. (Editors). Flore du Congo belge et du Ruanda-Urundi. Spermatophytes. Volume 6. Institut National pour l’Étude Agronomique du Congo belge, Brussels, Belgium. 426 pp.
- Hepper, F.N., 1958. Papilionaceae. In: Keay, R.W.J. (Editor). Flora of West Tropical Africa. Volume 1, part 2. 2nd Edition. Crown Agents for Oversea Governments and Administrations, London, United Kingdom. pp. 505–587.
- Holland, B., Unwin, I.D. & Buss, D.H., 1991. Vegetables, herbs and spices. The fifth supplement to McCance & Widdowson’s The Composition of Foods. 4th Edition. Royal Society of Chemistry, Cambridge, United Kingdom. 163 pp.
- ILDIS, 2002. World database of Legumes, Version 6,05. International Legume Database & Information Service. [Internet] http://www.ildis.org/. October 2003.
- Kee, E., Glancey, J.L. & Wootten, T.L., 1997. The Lima bean: a vegetable crop for processing. HortTechnology 7( 2): 119–128.
- Maquet, A., Vekemans, X. & Baudoin, J.P., 1999. Phylogenetic study on wild allies of Lima bean, Phaseolus lunatus (Fabaceae), and implications on its origin. Plant Systematics and Evolution 218(1–2): 43–54.
- Maquet, A., Zoro Bi, I., Delvaux, M., Wathelet, B. & Baudoin, J.P., 1997. Genetic structure of a Lima bean base collection using allozyme markers. Theoretical and Applied Genetics 95: 980–991.
- Paul, A.A., Southgate, D.A.T. & Russell, J., 1980. First supplement to McCance and Widdowson’s The composition of foods: amino acids (mg per 100 g food), fatty acids (g per 100 g food). Elsevier, Amsterdam, Netherlands. 112 pp.
- Polhill, R.M., 1990. Légumineuses. In: Bosser, J., Cadet, T., Guého, J. & Marais, W. (Editors). Flore des Mascareignes. Famille 80. The Sugar Industry Research Institute, Mauritius, l’Office de la Recherche Scientifique Outre-Mer, Paris, France & Royal Botanic Gardens, Kew, Richmond, United Kingdom. 235 pp.
- Schmit, V., du Jardin, P., Baudoin, J.P. & Debouck, D.G., 1993. Use of chloroplast DNA polymorphism for the phylogenetic study of seven Phaseolus taxa including P. vulgaris and P. coccineus. Theoretical and Applied Genetics 87: 506–516.
- Westphal, E., 1974. Pulses in Ethiopia, their taxonomy and agricultural significance. Agricultural Research Reports 815. Centre for Agricultural Publishing and Documentation, Wageningen, Netherlands. 263 pp.
- Williamson, J., 1955. Useful plants of Nyasaland. The Government Printer, Zomba, Nyasaland. 168 pp.
Sources de l'illustration
- Baudoin, J.P., 1989. Phaseolus lunatus L. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 57–60.
Auteur(s)
- J.P. Baudoin, Unité de Phytotechnie tropicale et d’Horticulture, Faculté Universitaire des Sciences agronomiques de Gembloux (FUSAGx), Passage des Déportés 2, 5030 Gembloux, Belgium
Citation correcte de cet article
Baudoin, J.P., 2006. Phaseolus lunatus L. In: Brink, M. & Belay, G. (Editors). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Netherlands. Consulté le 2 avril 2025.
- Voir cette page sur la base de données Prota4U.