Phaseolus acutifolius (PROTA)
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Céréale / légume sec | |
| Légume | |
| Médicinal | |
| Fourrage | |
| Auxiliaire | |
| Sécurité alimentaire | |
| Changement climatique | |
Phaseolus acutifolius A.Gray
- Protologue: Pl. wright. 1 : 43 (1852).
- Famille: Papilionaceae (Leguminosae - Papilionoideae, Fabaceae)
- Nombre de chromosomes: 2n = 22
Noms vernaculaires
- Haricot tépari, tépari (Fr).
- Tepary bean, Texas bean (En).
- Feijão tepari (Po).
Origine et répartition géographique
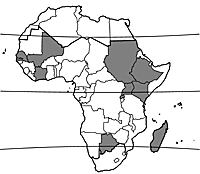
Le haricot tépari est une ancienne plante cultivée du sud-ouest des Etats-Unis et du nord du Mexique. D’après des recherches récentes, les vestiges les plus anciens de haricot tépari domestiqué proviennent de la vallée de Tehuacán au Mexique, et remontent à environ 2300 ans. L’analyse des isozymes suggère que sa domestication a eu lieu dans une seule zone géographique, qui pourrait se situer dans les états de Jalisco ou Sinaloa au Mexique. De nos jours, les formes sauvages sont réparties depuis le sud-ouest des Etats-Unis (Arizona, Nouveau-Mexique, Texas) jusqu’au Guatemala, avec un noyau central au nord-ouest du Mexique. Le haricot tépari est également cultivé au sud des Etats-Unis et en Amérique centrale. Après la seconde guerre mondiale, la culture du haricot tépari a fortement diminué, mais de nos jours elle recommence à susciter l’intérêt. Le haricot tépari a été introduit en Afrique, en Asie et en Australie, où il est cultivé. Introduit dans l’Afrique de l’Ouest francophone, en Afrique centrale, en Afrique de l’Est et à Madagascar entre les première et seconde guerres mondiales, il y est maintenant cultivé, et sa culture s’étend au sud jusqu’au Botswana. Il a aussi été signalé au Maroc, en Algérie, en Afrique du Sud, au Swaziland et au Lesotho.
Usages
Le haricot tépari est principalement cultivé pour ses graines mûres sèches, qui se consomment cuites à l’eau, à la vapeur, à l’huile ou au four. On les emploie en ragoûts et en soupes et on les mélange à des grains de maïs entiers. En Ouganda, les graines sèches se cuisent généralement à l’eau avant d’être grossièrement broyées pour être ajoutées aux soupes. Il arrive que l’on consomme le tépari comme haricot vert ou pour ses germes. Au Malawi, les feuilles sont réputées comestibles, mais elles sont plus dures que celles du haricot commun (Phaseolus vulgaris L.) et elles sont plus longues à cuire. Les gousses et les tiges qui subsistent après l’écossage peuvent servir à l’alimentation du bétail. Au Botswana, les graines servent couramment à améliorer l’alimentation des volailles. Le tépari a été parfois cultivé comme fourrage ou comme engrais vert, aux Etats-Unis par exemple. On peut s’en servir comme culture de couverture et comme culture associée dans un système agroforestier.
Production et commerce international
Le haricot tépari est cultivé principalement au Mexique et en Arizona (Etats-Unis). Une production commerciale à grande échelle a été tentée au début du XXe siècle, mais l’entreprise a été abandonnée en raison des caractéristiques morphologiques défavorables de la plante comparée au haricot commun, d’une modification des habitudes alimentaires et d’un manque d’information sur ses performances. Le tépari a récemment pris de l’importance dans les régions semi-arides d’Afrique tropicale, par ex. au Soudan, au nord-est du Kenya, en Ouganda et au Botswana, où la plupart des autres légumineuses à graines échouent en raison de la sécheresse et où l’on a besoin de cultures à cycle court. La production étant destinée surtout à la consommation intérieure, on ne dispose pas de statistiques de production et de commercialisation.
Propriétés
La composition de la graine sèche de haricot tépari par 100 g de partie comestible est de : eau 8,6 g, énergie 1478 kJ (353 kcal), protéines 19,3 g, lipides 1,2 g, glucides 67,8 g, fibres 4,8 g, Ca 112 mg, P 310 mg, thiamine 0,33 mg, riboflavine 0,12 mg, niacine 2,8 mg et acide ascorbique 0 mg (Leung, Busson & Jardin, 1968). Comme c’est le cas pour les autres légumes secs, les graines ont une faible teneur en acides aminés sulfurés, à savoir la méthionine et la cystine (0,9–1,3% et 0,8–1,3% des acides aminés totaux, respectivement). En ce qui concerne les facteurs antinutritionnels, tels que les inhibiteurs de trypsine, les oligosaccharides flatulents et l’acide phytique, le tépari est comparable au niébé et au pois chiche ; l’activité des lectines est exceptionnellement élevée, mais diminue facilement à la cuisson ; par contre, on n’a pas détecté de glucosides cyanogènes. On a observé que la consommation de farine crue de haricot tépari entraînait la mort des souris et des rats en 3–4 jours ; toutefois, un trempage et une cuisson en éliminent totalement la toxicité. De saveur et d’odeur prononcées, le haricot tépari est moins appétissant que le haricot commun. Après stockage, les graines sèches durcissent beaucoup et sont très longues à cuire. Les cultivars à graines blanches ont un tégument plus perméable que ceux à graines noires, ce qui diminue leur temps de cuisson.
Le foin de haricot tépari contient 6,6% d’eau, 9,9% de protéines, 1,9% de lipides, 43,1% d’extrait non azoté, 29,3% de fibres et 9,2% de cendres. Les gousses et les tiges contiennent 8% d’eau, 4,1% de protéines, 0,5% de lipides, 43,6% d’extrait non azoté, 37,0% de fibres et 6,8% de cendres.
Description
- Plante herbacée annuelle, grimpante, rampante ou plus ou moins érigée et buissonnante, à tiges atteignant 4 m de long ; racines fibreuses.
- Feuilles alternes, 3-foliolées ; stipules lancéolées, de 2–3 mm de long, apprimées à la tige ; pétiole de 2–10 cm de long ; stipelles linéaires, atteignant 2 mm de long ; folioles ovales à ovales-lancéolées, de 4–8 cm × 2–5 cm, aiguës, habituellement pubescentes en dessous.
- Inflorescence : grappe axillaire, à 2–5 fleurs.
- Fleurs bisexuées, papilionacées ; pédicelle de 3–7 mm de long ; calice campanulé, de 3–4 mm de long, les 2 lobes supérieurs réunis en un seul, les 3 inférieurs triangulaires ; corolle blanche, rose ou lilas pâle, étendard semi-réfléchi, large, émarginé, atteignant 1 cm de long, ailes atteignant 1,5 cm de long, carène étroite, spiralée ; étamines 10, dont 9 soudées et 1 libre ; ovaire supère, d’environ 0,5 cm de long, densément pubescent, style pourvu d’une spirale terminale épaissie, garni d’un collet de poils sous le stigmate.
- Fruit : gousse comprimée, droite ou légèrement courbe, de 5–9 cm × 0,5–1 cm, à bourrelets sur les bords, à bec court mais distinct, poilue à l’état jeune, contenant habituellement 2–9 graines.
- Graines globuleuses à oblongues, de 4–7(–10) mm × 2–5(–7,5) mm, blanches, jaunes, brunes, violacées, noires ou diversement marbrées, ternes.
- Plantule à germination épigée ; première paire de feuilles simple.
Autres données botaniques
Le genre Phaseolus comprend environ 50 espèces, dont la plupart se trouvent dans les Amériques. Trois variétés de Phaseolus acutifolius ont été distinguées sur la base de la morphologie des folioles et des graines. Var. acutifolius et var. tenuifolius A.Gray comprennent des formes sauvages issues du sud-ouest des Etats-Unis et du nord-ouest du Mexique ; var. latifolius G.F.Freeman comprend des formes aussi bien sauvages que cultivées. Les analyses d’isozymes et d’AFPL ne permettent pas de différencier clairement var. acutifolius et var. tenuifolius.
Croissance et développement
Les graines du haricot tépari absorbent facilement l’eau ; dans un sol humide, le tégument se ride en 5 minutes, et dans l’eau en 3 minutes, ce qui entraîne une germination très rapide. La levée est plus rapide pour les types à graines blanches que pour ceux à graines noires. Les graines des types domestiqués n’ont pas de dormance, ce qui présente un inconvénient dans les régions humides, où les graines tombées risquent de germer rapidement. Le taux de germination augmente lorsque la température monte de 10°C à 35°C. La floraison se produit en 27–40 jours. Les fleurs s’autofécondent avant l’anthèse. Dans les régions tropicales, il existe des types à cycle court capables de mûrir en 2 mois, mais la plupart ont une période de croissance de 70–90 jours. Dans les régions moins chaudes, comme la côte algérienne, la période de croissance est en moyenne de 120 jours. La plupart des types domestiqués de haricot tépari s’égrènent moins facilement que les types sauvages.
Chez le haricot tépari, la nodulation et la fixation d’azote ne sont efficaces qu’avec des isolats de Bradyrhizobium. Les hybrides de haricot tépari et de haricot commun (ce dernier formant des nodules avec Bradyrhizobium mais ne fixant l’azote atmosphérique que lorsque les nodules sont produits avec Rhizobium leguminosarum bv. phaseoli) peuvent se répartir en 2 groupes : un groupe ne fixant l’azote qu’avec Bradyrhizobium, et l’autre uniquement avec Rhizobium leguminosarum bv. phaseoli.
Ecologie
Le haricot tépari est particulièrement indiqué dans les régions arides, car il supporte la sécheresse, la chaleur et une atmosphère sèche. Les facteurs qui contribuent à cette tolérance à la sécheresse chez le tépari sont la sensibilité de ses stomates, qui se ferment alors que les potentiels en eau sont encore relativement élevés, et un système racinaire profond et étendu. Le tépari se trouve dans des régions dont la température annuelle moyenne est de 17–26°C ; la température nocturne minimale ne doit pas tomber sous la barre de 8°C. Il est capable de pousser dans les zones où la pluviométrie annuelle est de 500–1700 mm, mais lorsque celle-ci dépasse les 1000 mm, la croissance végétative est généralement excessive, au détriment du rendement en graines. Après la floraison, il ne faut que peu de pluie ou pas du tout. Si presque partout en Afrique on cultive le haricot tépari comme culture de saison courte, dans les régions humides il est cultivé toute l’année. Au Mexique et en Arizona, il se cultive généralement à des altitudes moyennes. Certains types de tépari ont besoin de jours courts pour fleurir, mais les autres semblent insensibles à la photopériode.
Les sols légers et bien drainés ont la faveur du tépari ; on peut obtenir des rendements moyens sur des sols sablonneux et pauvres à pH de 5–7. Par contre il ne supporte pas l’asphyxie racinaire et les argiles lourdes ne lui conviennent pas. Il tolère moyennement bien les terres salines et alcalines. Il se peut que sa tolérance au sel ne soit pas physiologique mais provienne de son aptitude à se soustraire à la salinité grâce à un système racinaire plus profond que celui du haricot commun, par exemple.
Multiplication et plantation
Le haricot tépari se multiplie par graines. Le poids de 1000 graines est de 100–220 g chez les génotypes cultivés et de 15–50 g chez les génotypes sauvages. Les graines se sèment à la volée à raison de 28–34 kg/ha, ou en lignes espacées de 60–90 cm, en ménageant 10–45 cm entre plantes sur la ligne. La profondeur de semis est de 2,5–10 cm. Le tépari se sème parfois sur buttes, à raison de 2–4 graines par butte. Au Kenya, il se sème à raison de 15–20 kg/ha, avec des espacements de 60 cm × 30 cm. Dans le cas d’une culture pour le foin, les besoins en semences sont de l’ordre de 70 kg/ha.
Le haricot tépari se cultive en culture pure ou en association avec des céréales (sorgho, mil, maïs), des légumes (Allium, Brassica , Capsicum, Cucurbita spp.), ou d’autres légumes secs. Aux Etats-Unis et au Mexique, le haricot tépari est parfois semé en mélange non trié avec le haricot commun, ce qui donne des rendements plus stables que ceux du haricot commun seul et des rendements potentiels plus élevés que ceux du tépari seul.
Gestion
Pour le haricot tépari, le désherbage est essentiel, surtout au début de sa croissance. Mais cultivé comme plante de “fin de saison”, il n’a pas besoin d’être beaucoup désherbé. On sait peu de choses sur ses besoins en nutriments, et sa réponse aux engrais azotés et potassiques n’est pas régulière. On peut irriguer, mais cela est peu pratiqué. En culture associée, ce sont les pratiques culturales de la culture principale qui s’appliquent au haricot tépari. Au Sénégal et au Mali, le tépari se cultive comme légume dans les jardins familiaux.
Maladies et ravageurs
D’ordinaire, le haricot tépari n’est pas touché par les maladies dans les régions semi-arides, sauf pendant les périodes de forte humidité. Au sein de l’espèce, il existe des niveaux de résistance variables contre la graisse bactérienne (Xanthomonas campestris pv. phaseoli), la rouille du haricot (Uromyces appendiculatus), la pourriture due à Fusarium sp., l’oïdium (Erysiphe polygoni), l’anthracnose (Colletotrichum lindemuthianum), les taches anguleuses des feuilles (Phaeoisariopsis griseola) et la pourriture charbonneuse (Macrophomina phaseolina). Le tépari est sensible à la pourriture blanche (Sclerotinia sclerotiorum), et on le considère également sensible à la graisse à halo (Pseudomonas syringae pv. phaseolicola) ; il est en outre cité comme hôte de la pourriture du collet (Sclerotium rolfsii) et de la pourriture due à Pythium aphanidermatum. Extrêmement sensible au virus de la mosaïque commune du haricot (BCMV), le tépari a également fait preuve de sensibilité au virus de la mosaïque de la luzerne (AMV), au virus de la mosaïque jaune du haricot (BYMV), au virus de la frisolée de la betterave (BCTV), au virus de la marbrure de la gousse du haricot (BPMV) et au virus de la mosaïque dorée du haricot (BGMV).
Des cicadelles (Empoasca kraemeri) et des foreurs de gousses (Epinotia opposita) ont été observés lors d’essais de stress hydrique. De nombreuses lignées ont fait preuve de résistance contre les cicadelles, mais le mécanisme est celui d’une non préférence plus que d’une antibiose. Il s’avère que la coccinelle mexicaine du haricot (Epilachna varivestis) et la cicadelle de la pomme de terre (Empoasca fabae) provoquent des dégâts sur le haricot tépari. On a observé une certaine résistance au puceron noir du haricot (Aphis fabae) ainsi qu’à la petite pyrale du maïs (Elasmopalpus lignosellus). La dureté de son tégument rend la graine résistante aux ravageurs des greniers, comme les bruches (Callosobruchus et Acanthoscelides spp.). En Ouganda, cependant, on a noté la présence du charançon du riz (Sitophilus oryzae) dans des stocks de graines.
Récolte
D’ordinaire, les gousses situées sur la même plante de tépari ne mûrissent pas toutes en même temps et comme elles s’égrènent si on les laisse sécher au champ, elles sont généralement récoltées à la main dès qu’elles commencent à changer de couleur, en général 2,5–3 mois après la plantation. Ce sont parfois les plantes entières que l’on arrache à la main. On fait normalement sécher les gousses quelques jours avant de procéder au battage. En Afrique, il est d’usage de taper sur les gousses ou les plantes sèches avec des bâtons pour effectuer le battage du tépari.
Rendement
En Ouganda, les rendements moyens de haricot tépari sont de 450–670 kg de graines sèches par ha. En culture sèche aux Etats-Unis, les rendements sont de 500–800 kg/ha, et sous irrigation de 900–1700 kg/ha. Lorsqu’il s’agit d’une culture fourragère, on peut obtenir 5500–11 000 kg/ha de foin (en matière sèche).
Traitement après récolte
Contrairement à la plupart des autres légumes secs, les graines de tépari se conservent bien et n’ont pratiquement besoin d’aucune mesure de protection contre les ravageurs des greniers.
Ressources génétiques
La base génétique du haricot tépari cultivé est plus étroite que celle du haricot commun et du haricot de Lima (Phaseolus lunatus L.), et la plus grande diversité génétique en vue de son amélioration réside dans les formes sauvages. Il est recommandé de collecter les ressources génétiques provenant de l’aire d’origine du tépari. Le pool génique du tépari sauvage a diminué suite à la destruction et à la dégradation des milieux ; le tépari domestiqué quant à lui a souffert d’érosion génétique en raison de la diminution de sa superficie cultivée. L’échange d’information génétique entre le haricot commun et le haricot tépari est possible, mais seulement pour des caractères simples n’impliquant que peu de gènes. Bien que le haricot commun et le haricot tépari possèdent le même nombre de chromosomes et des caryotypes similaires, leurs génomes mitochondriaux, leur adaptation agro-écologique et leurs caractéristiques morphologiques sont distincts, preuve qu’il s’agit d’espèces bien différenciées.
La plus grande collection de ressources génétiques de tépari (environ 350 entrées) est détenue au CIAT (Centre international d’agriculture tropicale) à Cali (Colombie). Une autre collection importante se trouve à l’USDA-ARS Western Regional Plant Introduction Station, Washington (Etats-Unis) (211 entrées). Des collections plus petites sont détenues en Australie (Australian Tropical Crops & Forages Genetic Resources Centre, Biloela ; 70 entrées), en Belgique (Jardin botanique national de Belgique, Meise ; 59 entrées), au Mexique (Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Col. San Rafael ; 40 entrées) et au Guatemala (Centro Universitario de Sur Occidente (CUNSUROC), Universidad de San Carlos, Mazatenango ; 31 entrées). En Afrique, 29 entrées sont détenues à l’ISRA (Institut sénégalais de recherches agricoles) à Dakar (Sénégal) et 10 entrées à l’ILRI (Institut international de recherche sur le bétail), à Addis Abéba (Ethiopie). La plupart des collections comprennent aussi bien des formes sauvages que cultivées.
Sélection
Le haricot tépari est généralement résistant aux maladies et aux ravageurs, tolérant à la sécheresse, la chaleur et la salinité et il possède un cycle de culture court. Les perspectives de sélection sont favorables, car il existe au sein de l’espèce suffisamment de variation dans la résistance aux facteurs de stress biotiques et abiotiques. A l’exception de quelques populations issues de sélection massale, aucun cultivar amélioré de haricot tépari n’a été mis à la disposition des producteurs. Les caractères favorables du tépari ont surtout servi à améliorer le haricot commun plutôt que le tépari lui-même. Sa résistance à la graisse bactérienne, par exemple, a été transférée au haricot commun par hybridation interspécifique. Lors des essais de croisement de Phaseolus acutifolius avec Phaseolus vulgaris, la fécondation croisée artificielle ne pose aucun problème ; cependant des barrières post-zygotiques empêchent habituellement la formation d’un embryon normal et en règle générale on n’obtient pas d’hybrides viables. On a habituellement besoin de recourir au sauvetage d’embryons par culture in vitro pour mener l’hybridation à terme. Par croisements de retour répétés avec l’un et l’autre des parents en alternance, les hybrides deviennent fertiles et se croisent avec les deux espèces. Ce sont toutefois les gènes provenant du haricot commun qui tendent à prédominer dans ces hybrides. On a aussi obtenu des graines à partir d’un croisement faisant intervenir une entrée de Phaseolus acutifolius (NI 576) sans passer par la culture in vitro. Cette entrée a pu être transformée génétiquement par le biais d’Agrobacterium, puis de culture de tissus, ouvrant ainsi la voie à une utilisation de Phaseolus acutifolius pour introduire des transgènes dans Phaseolus vulgaris, qui est plus important sur le plan économique.
Perspectives
Le haricot tépari semble être une culture très indiquée pour les paysans pauvres d’Afrique, étant donné sa germination rapide, son système racinaire profond et son cycle de vie court, qui le rendent bien adapté à une production dans les régions arides ou semi-arides. Parmi les raisons de la réticence à adopter le tépari dans l’alimentation, on trouve la petite taille de la graine, sa tendance à provoquer des flatulences, sa longue durée de cuisson, la pénibilité de sa récolte et une saveur prononcée, voire une odeur désagréable selon certaines personnes. Il n’empêche que dans le nord du Kenya et du Nigeria, les mets traditionnels préparés avec du haricot tépari en remplacement du niébé ont été jugés tout à fait acceptables. Pour promouvoir ce haricot en Afrique, il sera nécessaire de sélectionner des cultivars à haut rendement, d’élaborer des produits alimentaires (suppléments protéiniques) à odeur moins forte, et de mettre en place une infrastructure de commercialisation.
Références principales
- CIAT, 2003. Bean improvement for the tropics. Project IP-1. Annual Report 2002. Centro Internacional de Agricultura Tropical (CIAT), Cali, Colombia.
- Dillen, W., de Clercq, J., Goossens, A., van Montagu, M. & Angenon, G., 1997. Agrobacterium mediated transformation of Phaseolus acutifolius A. Gray. Theoretical and Applied Genetics 94(2): 151–158.
- Hornetz, B., 1993. On the development and acceptance of agropastoral (agrosilvipastoral) systems in the semiarid areas of northern Kenya. In: Baum, E., Wolff, P. & Zöbisch, M.A. (Editors). Acceptance of soil and water conservation strategies and technologies. Topics in applied resource management in the tropics. Volume 3. pp. 413–453.
- Jansen, P.C.M., 1989. Phaseolus acutifolius A. Gray. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 54–55.
- Kaplan, L. & Lynch, T.F., 1999. Phaseolus (Fabaceae) in archaeology: AMS radiocarbon dates and their significance for pre-Colombian agriculture. Economic Botany 53(3): 261–272.
- Kay, D.E., 1979. Food legumes. Crops and Product Digest No 3. Tropical Products Institute, London, United Kingdom. 435 pp.
- Miklas, P.N., Rosas, J.C., Breaver, J.S., Telek, L. & Freytag, G.F., 1994. Field performance of selected tepary bean germplasm in the tropics. Crop Science 34: 1639–1644.
- National Academy of Sciences, 1979. Tropical legumes: resources for the future. National Academy of Sciences, Washington, D.C., United States. 331 pp.
- Pratt, R.C. & Nabhan, G.P., 1988. Evolution and diversity of Phaseolus acutifolius genetic resources. In: Gepts, P. (Editor). Genetic resources of Phaseolus beans: their maintenance, domestication, evolution, and utilization. Kluwer Academic Publishers, Dordrecht, Netherlands. pp. 409–440.
- Tinsley, A.M., Scheerens, J.C., Alegbejo, J.O., Adan, F.H., Krumhar, K.C., Butler, L.E. & Kopplin, M.J., 1985. Tepary beans (Phaseolus acutifolius var. latifolius): a potential food source for African and Middle Eastern cultures. Qualitas Plantarum: Plant Foods for Human Nutrition 35(2): 87–101.
Autres références
- Aganga, A.A., Omphile, U.J., Malope, P., Chabanga, C.H., Motsamai, G.M. & Motsumi, L.G., 2000. Traditional poultry production and commercial broiler alternatives for small-holder farmers in Botswana. Livestock Research for Rural Development 12(4): 1–8.
- Baudoin, J.P. & Maquet, A., 1999. Improvement of protein and amino acid contents in seeds of food legumes. A case study in Phaseolus. BASE, Biotechnologie, Agronomie, Société et Environnement 3(4): 220–224.
- Debouck, D.G. & Smartt, J., 1995. Beans. In: Smartt, J. & Simmonds, N.W. (Editors). Evolution of crop plants. 2nd Edition. Longman, London, United Kingdom. pp. 287–294.
- Freytag, G. & Debouck, D.G., 2002. Taxonomy, distribution and ecology of the genus Phaseolus (Leguminosae - Papilionoideae) in North America, Mexico and Central America. Botanical Institute of Texas, Fort Worth, Texas, United States. 300 pp.
- Garvin, D.F. & Weeden, N.F., 1994. Isozyme evidence supporting a single geographic origin for domesticated tepary bean. Crop Science 34(5): 1390–1395.
- Idouraine, A., Tinsley, A.M. & Weber, C.W., 1989. Nutritional quality and sensory acceptability of akara prepared from germinated tepary beans. Journal of Food Science 54(1): 114–117.
- Idouraine, A., Weber, C.W. & Kohlhepp, E.A., 1995. Composition of tepary bean (Phaseolus acutifolius) of the southwestern US and northern Mexico. Ecology of Food and Nutrition 33(3): 139–147.
- Kaiser, W.J., 1981. Diseases of chickpea, lentil, pigeon pea, and tepary bean in continental United States and Puerto Rico. Economic Botany 35(3): 300–320.
- Leung, W.-T.W., Busson, F. & Jardin, C., 1968. Food composition table for use in Africa. FAO, Rome, Italy. 306 pp.
- Lin, T.Y. & Markhart III, A.H., 1996. Phaseolus acutifolius A. Gray is more heat tolerant than P. vulgaris L. in the absence of water stress. Crop Science 36(1): 110–114.
- Markhart III, A.H., 1985. Comparative water relations of Phaseolus vulgaris L. and Phaseolus acutifolius Gray. Plant Physiology 77(1): 113–117.
- Mogotsi, K.K., 1982. Evaluation of factors influencing growth, development and yield of grain legumes. MSc Thesis, Texas Tech University, Lubbock, Texas, United States. 83 pp.
- Muñoz, L.C., Blair, M.W., Duque, M.C., Tohme, J. & Roca, W., 2004. Introgression in common bean × tepary bean interspecific congruity-backcross lines as measured by AFPL markers. Crop Science 44 (2): 637–645.
- Nabhan, G.P. & Felger, R.S., 1978. Teparies in southwestern North America. A biogeographical and ethnohistorical study of Phaseolus acutifolius. Economic Botany 32(1): 2–19.
- Purseglove, J.W., 1968. Tropical Crops. Dicotyledons. Longman, London, United Kingdom. 719 pp.
- Schinkel, C. & Gepts, P., 1988. Phaseolin diversity in the tepary bean, Phaseolus acutifolius A. Gray. Plant Breeding 101(4): 292–301.
- Somasegaran, P., Hoben, H.J. & Lewinson, L., 1991. Symbiotic interactions of Phaseolus acutifolius and P. acutifolius × P. vulgaris hybrid progeny in symbiosis with Bradyrhizobium spp. and Rhizobium leguminosarum bv. phaseoli. Canadian Journal of Microbiology 37(7): 497–503.
- Stanton, W.R., 1966. Grain legumes in Africa. FAO, Rome, Italy. 183 pp.
- Thorn, K.A., Tinsley, A.M., Weber, C.W. & Berry, J.W., 1983. Antinutritional factors in legumes of the Sonoran desert. Ecology of Food and Nutrition 13(4): 251–256.
- White, J.W. & Montes, R.C., 1993. The influence of temperature on seed germination in cultivars of common bean. Journal of Experimental Botany 44(269): 1795–1800.
Sources de l'illustration
- Jansen, P.C.M., 1989. Phaseolus acutifolius A. Gray. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 54–55.
Auteur(s)
- K.K. Mogotsi, Botswana College of Agriculture, Private Bag 0027, Gaborone, Botswana
Citation correcte de cet article
Mogotsi, K.K., 2006. Phaseolus acutifolius A.Gray. In: Brink, M. & Belay, G. (Editors). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Netherlands. Consulté le 18 décembre 2024.
- Voir cette page sur la base de données Prota4U.