Eryngium foetidum (TRAMIL)
| |
- Nom accepté : Eryngium foetidum
- Voir sur la TRAMILothèque (davantage d’illustrations)
Sommaire
Noms vernaculaires significatifs TRAMIL
- bateyes haïtiens en RD : koulant
- Costa Rica : culantro de coyote, spirit weed
- La Dominique, Martinique, Sainte Lucie, Tobago : chadwon beni, fit weed
- Honduras : culantro
- Rép. Dominicaine : cilantro ancho
- autres noms créoles : zèb a fè, zépyant
Distribution géographique
Originaire d’Amérique tropicale, introduite et naturalisée en Afrique tropicale.
Description botanique
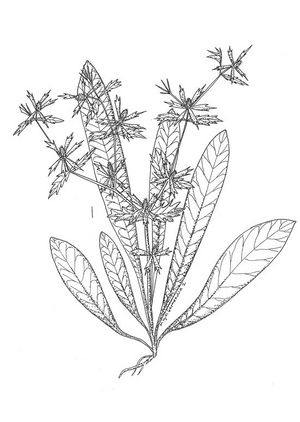
Herbe pérenne, glabre, pouvant atteindre 60 cm. Feuilles lancéolées à oblongues-lancéolées pouvant atteindre 30 cm de long, crénelées à finement denticulées, minces à la base, laquelle forme un pétiole court, en forme d’aile. Inflorescences caractérisées par une fleur terminale, et deux autres situées sur des tiges latérales opposées, amplement ramifiées avec capitules vert-jaunes; bractées en forme de collerette, lancéolées-foliacées, dépassant les capitules. Fruit arrondi, comprimé sur les côtés, abondamment recouvert d’écailles.
Vouchers :
- Ocampo,5013,CR
- Ochoa,280,HPMHV
- Jiménez,125,JBSD
- Jean Pierre,105,SLNH
- Delaigue,12,NHTT
- Longuefosse&Nossin,16,HAVPM
Emplois traditionnels significatifs TRAMIL
- douleurs de poitrine et attaques, palpitations et fatigue : feuille, décoction, voie orale1
- fièvre : plante entière, décoction ou infusion, voie orale2-5
- flatulences : feuille, décoction ou infusion, voie orale6
- grippe : feuille, décoction ou infusion, voie orale7
- vomissements : feuille, décoction ou infusion, voie orale8
Recommandations
Selon l’information disponible :
L’emploi contre les douleurs de poitrine et les attaques, les palpitations et la fatigue est classé REC sur la base de l’emploi significatif traditionnel documenté par les enquêtes TRAMIL et les études de toxicité. Nous ne disposons pas d’un modèle expérimental approprié pour valider l’activité pharmacologique correspondant à cet usage traditionnel.
Si l’état du patient se détériore ou si les douleurs de poitrine et attaques, palpitations et fatigue durent plus de 7 jours, consulter un médecin.
L’emploi contre la fièvre est classé REC sur la base de l’emploi significatif traditionnel documenté par les enquêtes TRAMIL, les études de toxicité et de validation. L’emploi contre les flatulences, la grippe, les vomissements, est classé REC sur la base de l’emploi significatif traditionnel documenté par les enquêtes TRAMIL et les études de toxicité.
Si l’état du patient se détériore ou si la fièvre ou les vomissements durent plus de 2 jours, consulter un médecin.
Ne pas employer avec des enfants de moins 3 ans, ni avec des femmes enceintes ou allaitantes.
Chimie
La plante contient des flavonoïdes, des saponines, des stérols, des triterpénoïdes, des tanins9; son huile essentielle est constituée principalement par : dodéc-2-trans-èn-1-al (59%) et dérivés, 2,4,5-triméthylbenzaldéhyde (37%) et dérivés, acide 2-méthyl-crotonique, formyl-triméthylcyclohexadiénol, cyménol, férurol, limonène10.
Les parties aériennes sont riches en calcium, fer, riboflavine et carotène11.
La feuille ne contient pas d’alcaloïdes12.
Activités biologiques
Travail TRAMIL13
L’extrait aqueux (décoction) de feuille (50%) par voie sous-cutanée administré au rat albinos traité au préalable avec de la levure de bière (15%) administrée par la même voie a montré une activité antipyrétique statistiquement significative, après comparaison avec le groupe témoin qui avait reçu du diclofénac.
Travail TRAMIL14
L’extrait aqueux (infusion) de feuille (10%) administré par voie orale au rat, a montré une activité antispasmodique.
Travaux TRAMIL15-16
L’extrait aqueux (décoction) de feuille séchée (250 mg/ kg), par voie orale au rat Wistar mâle (200-250 g), modèle in vivo d’inflammation induite par la carraghénine sur la patte a produit une diminution de l’oedème, la dose efficace réduisant 50% de l’inflammation (DE50) a été de 231,78 mg de résidu sec/kg, équivalente à 1,75 g de plante/kg.
Selon le modèle d’oedème induit par application topique d’acétate de tétradécanoïlphorbol (TPA) sur oreille de souris Swiss mâle (20-25 g), l’inhibition de l’oedème a été dose dépendante avec une DE50 de 9,88 mg de résidu sec/kg, équivalente à 0,075 g de plante/kg.
Enfin in vitro modèle de l’enzyme myélopéroxydase (MPO), l’inhibition dose dépendante a été moins significative.
L’extrait aqueux (décoction) de parties aériennes in vitro a induit une activité antipaludique sur Plasmodium gallinaceum17 et Plasmodium falciparum (100 μg/mL)18. L’extrait n’a pas inhibé la croissance d’Escherichia coli, de Salmonella typhi ni de Shigella flexneri19.
Toxicité
Travail TRAMIL15
La DL50 de la feuille, administrée par voie orale au rat, est de 11,12 ± 0,94 g/kg (poids exprimé en g de matière végétale sèche). Au cours de l’essai chronique, on n’a pas observé de signes évidents de toxicité ni de lésions macroscopiques sur les rein, foie et moelle osseuse à la nécropsie.
Travail TRAMIL20
L’extrait aqueux (décoction) lyophilisé de plante entière congelée (2 g/kg), par voie orale (5 jours consécutifs/ semaine/70 jours) à 20 souris albinos mâles, n’a pas entraîné la mort. Cependant, 80% des animaux ont présenté divers signes de toxicité : diminution du réflexe de redressement et d’érection pilomotrice 24 heures après le début du traitement, diminution de l’activité préhensile antéro-postérieure et de la réaction d’alarme à partir du 10ème jour, inflammation oculaire et apparition de nodosités dans la zone du cou à partir du 29ème jour. Toutes ces manifestations ont perduré jusqu’à la fin de l’expérience. On a constaté une hypothermie chez 50% des animaux. La glycémie sanguine, le taux d’hématocrite, la tolérance au glucose et la sensibilité à l’insuline n’a pas significativement varié dans le groupe traité par rapport au groupe témoin.
Travail TRAMIL21
L’extrait aqueux (décoction à 70 mg/mL) lyophilisé de plante entière, (1 g/kg/jour/70 jours consécutifs) par voie orale à la souris Hsd:ICR, (6 mâles et 6 femelles), modèle OECD 407 modifié par le LEBi, n’a pas montré de signes de toxicité et n’a pas induit de mortalité. Le témoin a été réalisé avec de l’eau distillée et désionisée (0,5 mL) sur 12 autres souris de mêmes caractéristiques. Au bout des 84 jours, aucune mortalité, signes évidents de toxicité ni signe histopathologique sur le foie, poumon, rein ni coeur n’a été observé.
Les extraits éthanoliques (90 et 95%) des parties aériennes et racine séchées, (1 g/kg) par voie orale à la souris, n’ont pas montré de signes de toxicité. Les mêmes extraits de racine sèche (50 mg/kg), par voie intraveineuse, n’a pas non plus montré de signes de toxicité9.
On ne dispose pas d’information garantissant l’innocuité de son emploi médicinal avec des enfants, ni avec des femmes enceintes ou allaitantes.
Préparation et dosage
La feuille d’Eryngium foetidum constitue un condiment de consommation humaine relativement répandue.
Pour tous les usages significatifs rapportés :
Préparer une décoction ou une infusion avec 20-30 grammes (2-3 cuillerées) de feuilles dans 4 tasses (1 litre) d’eau. Pour la décoction faire bouillir 10 minutes dans un récipient couvert. Pour l’infusion, verser l’eau bouillante sur 20-30 grammes de feuille, couvrir et laisser refroidir. Filtrer et boire 1 tasse 3 fois par jour.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- OCAMPO R, 1988 Encuesta TRAMIL (Costa atlántica), Instituto de Desarrollo Agrario, Universidad de Costa Rica, San José, Costa Rica.
- CHARLES C, 1988 TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
- JEAN-PIERRE L, 1988 TRAMIL survey. St. Lucia National Herbarium, Castries, St. Lucia.
- LONGUEFOSSE JL, NOSSIN E, 1990-95 Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
- DELAIGUE J, 2005 TRAMIL survey. PRDI, Tobago House of Assembly, Scarborough, Tobago.
- GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- LAGOS-WITTE S, 1988-1995 Encuestas TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
- WENIGER B, 1987-88 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- FORGACS P, JACQUEMIN H, MORETTI C, PROVOST J, TOUCHE A, 1983 Etude phytochimique et activités biologiques de 18 plantes de la Guyane Française. Plantes Médicinales Phytothér 17(1):22-32.
- WONG K, FENG M, SAM T, TAN G, 1994 Composition of the leaf and root oils of Eryngium foetidum L. J Essent Oil Res 6(4):369-374.
- MUNSELL H, WILLIAMS LO, GUILD LP, TROESCHER CB, NIGHTINGALE G, HARRIS RS, 1950 Composition of food plants of Central America. IV: El Salvador. Food Res 15(4):263-296.
- ARBAIN D, CANNON JR, AFRIASTINI, KARTAWINATA K, DJAMAL R, BUSTARI A, DHARMA A, ROSMAWATY H, SJAFAR M, SJAIFUL, NAWFA R, KOSELA S, 1989 Survey of some West Sumatran plants for alkaloids. Econ Bot 43(1):73- 78.
- HERRERA J, 1992 Determinación de parámetros farmacológicos usados en medicina tradicional popular en la Cuenca del Caribe. Departamento de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
- SARAVIA A, 1992 Estudios sobre plantas TRAMIL. Departamento de Farmacología, Universidad de San Carlos, Guatemala, Guatemala.
- GARCIA D, SAENZ T, 1995 Toxicidad aguda de algunas plantas TRAMIL. Informe TRAMIL. Farmacognosia, Facultad de Farmacia, Universidad de Sevilla, Sevilla, España.
- SAENZ MT, FERNANDEZ MA, GARCIA MD 1997 Anti-inflammatory and analgesic properties from leaves of Eryngium foetidum L. (Apiaceae). Phytother Res 11:380-383.
- SIMON O, SINGH N, 1986 Demonstration of anticonvulsant properties of an aqueous extract of spirit weed (Eryngium foetidum). Wi Med J 35(2):121-125.
- SAUVAIN M, 1989 Etude des plantes antiparasitaires du plancton des Guyanes en Amazonie : antipaludiques et antileishmanioses (Thèse de Doctorat). Université Paris-Sud, Paris, France.
- CACERES A, SAMAYOA B, 1989 Tamizaje de la actividad antibacteriana de plantas usadas en Guatemala para el tratamiento de afecciones gastrointestinales. Guatemala, Guatemala: Dirección General de Investigaciones, Universidad de San Carlos (DIGI-USAC).
- GARCIA GM, COTO MT, GONZALEZ CS, PAZOS L, 1996 Toxicidad sub-crónica, en ratones, del extracto acuoso de la planta entera de Eryngium foetidum. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.
- PAZOS L, COTO T, GONZALEZ S, QUIROS S, 2004 Toxicidad oral, subcrónica en ratones, dosis repetidas, del extracto acuoso de planta entera de Eryngium foetidum. Informe TRAMIL. Laboratorio de Ensayos Biológicos LEBi, Escuela de Medicina, Universidad de Costa Rica, San Pedro, Costa Rica.