Psidium guajava (TRAMIL)
| |
- Nom accepté : Psidium guajava
- Voir sur la TRAMILothèque (davantage d’illustrations)
Sommaire
Noms vernaculaires significatifs TRAMIL
- Colombie, Cuba, Guatemala, Mexique, Panama, Rép. Dominicaine, Venezuela : guayaba
- La Dominique, Guadeloupe, Haïti, La Désirade, Les Saintes, Marie-Galante, Martinique : goyav, gwayav
- Belize, Grenade, Tobago : guava
- Honduras : guayabo
- autres noms créoles : pyé gwayav, griyav, gouyav, goyavier, goyave
Distribution géographique
Originaire d’Amérique tropicale, naturalisée dans les régions tropicales et subtropicales de l’Ancien Monde.
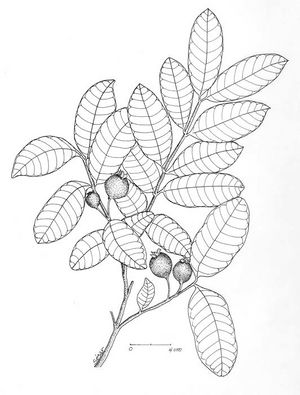
Description botanique
Arbre ou arbuste pouvant atteindre 10 m de haut, écorce squameuse. Feuilles opposées à court pétiole, elliptiques à oblongues, subcoriaces, avec nervures visiblement imprimées sur la partie supérieure, proéminentes sur l’inférieure. Fleurs blanches, solitaires ou en groupes de 2 à 3, sur fins pédoncules; nombreuses étamines. Fruit comestible, arrondi ou piriforme, jaune, de 3 à 6 cm de diamètre.
Vouchers :
- Delens,23,VEN
- Gimenez,275705-33,VEN
- Girón,267,CFEH
- Jiménez,41,JBSD
- Medina,41,CICY
- Longuefosse&Nossin,32,HAVPMC
- Pinzón,21898,CUVC
- Espinosa,6178,FLORPAN
- Delaigue,24,NHTT
- Soto,45862,CR
- Fuentes,4754,ROIG
- Boulogne,TH,16,UAG/TB,14,UAG
Emplois traditionnels significatifs TRAMIL
- crise de nerfs : feuille, décoction avec du sel et du sucre, voie orale, et friction en association fréquente avec Annona muricata1
- diarrhée : fruit, naturel, voie orale2-3 ; fruit, jus, avec du sel ou du sucre, voie orale4 ; feuille, décoction ou infusion (parfois avec du sel ou du sucre), voie orale1,4-7 ; feuille, pilée-froissée, voie orale3,8 ; boutons et pousses foliaires, infusion, voie orale8-13 ; fleur et pousse, décoction ou infusion, voie orale3,14-15 ; écorce de tige fraîche, décoction, voie orale16-18
- état éthylique ou gueule de bois (étourdissements) : feuille, décoction, avec du sucre et du sel, voie orale en association fréquente avec Allium sativum et Bunchosia glandulosa1
- vomissements : boutons, décoction ou infusion, voie orale1
- boutons cutanés : pousses foliaires, décoction, voie topique en bassine19
- éruptions cutanées : feuille fraîche, décoction, en bain, seule ou en association avec Hamelia patens et Punica granatum, on l’utilise aussi en association avec Spondias purpurea20
Recommandations
Selon l’information disponible :
L’emploi contre les crises de nerfs, la diarrhée et les éruptions cutanées est classé REC sur la base de l’usage significatif traditionnel documenté par les enquêtes TRAMIL, les études de toxicité, la validation et l’information scientifique publiée.
Si l’état du patient se détériore, ou si les crises de nerfs durent plus de 7 jours, consulter un médecin.
Si l’état du patient se détériore, ou si les crises de nerfs durent plus de 7 jours, consulter un médecin, ou si on observe chez le patient atteint de diarrhée la deshydratation avec langue sèche, pli cutané persistant, oligurie ou pleurs sans larmes, consulter un médecin immédiatement. Si la diarrhée dure plus de 3 jours chez un adulte ou plus d’un jour chez un enfant, ou les éruptions cutanées plus de 5 jours, consulter un médecin.
En cas de diarrhée, ce remède est complémentaire à une thérapie de réhydratation orale.
Toute application topique doit se conformer à de strictes mesures d’hygiène, pour éviter la contamination ou une infection supplémentaire.
L’emploi contre l’état éthylique (gueule de bois) et le vomissement est classé REC sur la base de l’usage significatif traditionnel documenté par les enquêtes TRAMIL et les études de toxicité.
Si l’état du patient se détériore, ou si la gueule de bois ou les vomissements durent plus de 2 jours, consulter un médecin.
Ne pas employer avec des femmes enceintes ou allaitantes , ni avec des enfants de moins de 3 ans.
Chimie
Travail TRAMIL21
L’extrait aqueux (décoction) de feuille n’a pas permis de détecter la présence de quercétine, on a seulement trouvé de la quercétrine à une concentration de 0,0059 mg/mL (équivalents 0,0044 mg/mL de quercétine). En revanche, on a détecté dans l’extrait méthanolique la présence de quercétine à une concentration de 0,0174 mg/mL, et celle de quercétrine à une concentration de 0,0549 mg/mL.
Le fruit contient de l’huile essentielle : idine; β-bisabolène, δ-cadinène, caryophilène et dérivés, α-humulène, α et β-sélinènes22-24, curcumène, farnésène22; des flavonoïdes : guaijavérine, quercétine21,24, leucocyans; des triterpènes : α et β-amyrine, et dérivés, lupéol, acides arjunolique, asiatique, protobassique, brahmique, maslinique, ursolique25 et oléanolique25-26; des benzénoïdes : benzaldéhyde23,25, acide diphénique, acide gallique24, acétate de 2-phénéthyl, p-méthyl-styrène, toluène23; des composés sulfurés : benzothiazol, 2-méthyl-thiobenzothiazol, diméthyl disulfure, diméthyl trisulfure, diisopropyl-disulfure, 6-mercapto-hexan-1-ol, pentan- 2-thiol, diméthyl-sulfone, 5-étoxy-thiazol, 2-éthylthiophène, 2-méthyl-thiophène, 3-méthyl-thiophène27, stéroïdes25-26, lipides; des coumarines24,28; oxygène hétérocyclique23; des alcanes23,27,29; des alcènes23.
La fleur contient des flavonoïdes : guaijavérine, quercétine24,30, leucocyanidine24, des triterpènes : acide oléanolique30.
La feuille contient des benzénoïdes : amritoside, acide ellagique31, acide gentisique32, pendunculagine33, flavonoïdes : guaijavarine, hypéroside34, guaijavérine, leucocyanidine31, procyanidine B-1, B-2 et B-335, quercétine31,36, iso-quercétine, quercétin-3-O-gentiobioside, quercitrine34, tanins : casuarinine37, guavine A38, B35, C et D38, pédunculagine, stachyurine, strychnine, iso-strychtine, télimagrandine I37, triterpènes : acides maslinique, oléanolique et ursolique39, monoterpènes : α-pinène40.
L’écorce de la tige contient des benzénoïdes : amritoside, acide ellagique31; des flavonoïdes; des tanins35.
Analyse proximale pour 100 g de fruit41: calories : 69; eau : 80,6%; protéines : 1%; lipides : 0,4%; glucides : 17,3%; fibres : 5,6%; cendres : 0,7%; calcium : 15 mg; phosphore : 24 mg; fer : 0,7 mg; sodium : 4 mg; potassium : 291 mg; carotène : 75 μg; thiamine : 0,05 mg; riboflavine : 0,04 mg; niacine : 1,10 mg; acide ascorbique : 132 mg.
Analyse proximale pour 100 g de feuille séchée41: eau : 0%; protéines : 11,7%; lipides : 8,7%; glucides : 71,9%; fibres : 16,1%; cendres : 7,7%; calcium : 1340 mg; phosphore : 160 mg.
Activités biologiques
Travaux TRAMIL42-43
L’extrait éthanolique (20 g/100 mL d’éthanol 70% v/v), dissout dans 30 mL d’eau (10 mL toutes les 8 heures), par voie orale à des humains qui présentaient des symptômes de diarrhée aiguë simple, a augmenté significativement le nombre de patients guéris au bout de 24, 48 et 72 heures, par rapport au témoin.
Travail TRAMIL44
L’extrait éthanolique (80%) de feuille sèche, obtenu par percolation et dégraissé à l’éther de pétrole (50, 100 et 300 mg/mL) par voie orale à la souris, modèle d’activité motrice par mesure des déplacements horizontaux (équipe Varimex), a provoqué une diminution significative (p<0,001) dose-dépendante de l’activité motrice.
Cette diminution s’est maintenue au cours des 90 minutes ayant suivi l’administration.
Travail TRAMIL45
La teinture de feuille (20 g/100 mL d’éthanol 70% v/v), (200, 400 et 800 mg/kg) par voie orale à la souris mâle Swiss, a diminué significativement le transit intestinal, selon une action dose dépendante.
Travail TRAMIL46
L’extrait aqueux (décoction à 4,78%) lyophilisé d’écorce de tige fraîche, concentration 333,33 mg/mL d’eau, (1000 mg/kg/jour) par voie orale à la souris Hsd:ICR de 24,3 ± 1,5 g (4 mâles et 4 femelles). Les groupes témoins de mêmes caractéristiques ont reçu de l’eau distillée (0,3 mL/20 g de poids corporel), de la piridostigmine (3,5 mg/kg) et de l’atropine (50 mg/kg). Selon la méthode de Wei-Wei Zhang47, le charbon actif a servi de marqueur de la vitesse du transit intestinal, mesuré une heure après l’administration de l’extrait, sans qu’il soit observé de modification statistiquement significative (p>0,05).
Travail TRAMIL48
L’extrait hydroalcoolique (40%) de feuille séchée (107 mg/ mL), (100 L/puits) in vitro, modèle de diffusion sur plaque d’agar-agar, a eu un pouvoir inhibiteur inférieur à 50% par rapport aux témoins sur la croissance de Staphylococcus aureus ATCC15008, Escherichia coli ATCC25922 et n’a pas eu d’effet sur Candida albicans ATCC10231.
Travaux TRAMIL49-50
L’extrait aqueux (décoction à 50%) d’écorce de tige fraîche et celui de feuille fraîche, (100 μL/puit) in vitro, ont été actifs contre Staphylococus aureus (ATCC 29737) mais pas contre Escherichia coli (ATCC 10536) ni Candida albicans (ATCC 10231).
L’extrait aqueux (décoction) de feuille sèche (1 g de matériel végétal dans 16 mL d’eau bidistillée et réduit pour obtenir 4 mL), in vitro (0,1; 1, 5 et 10% v/v), a montré une activité sur la virulence de pathogènes communs de la diarrhée, la colonisation de cellules épithéliales, la production et l’action d’entérotoxines, témoins avec quercétine, a été actif contre Shigella flexneri et Vibrio cholerae. Il a diminué la production d’entérotoxine thermolabile (LT) par Escherichia coli ainsi que de la toxine du choléra (CT). Il a également inhibé l’adhérence d’E. coli entéropathogène (EPEC) et l’invasion par E. coli entéroinvasif (EIEC) et de S. flexneri aux cellules HEp-2. Ces résultats indiquent une action antidiarrhéique efficace et non uniquement due à la quercetine51. L’extrait aqueux de feuille a été actif in vitro sur Escherichia coli, Sarcina lutea, Serratia marcescens, Shigella flexneri, Staphylococcus albus et S. aureus52 ainsi que sur des souches d’Epidermophyton floccosum et de Candida albicans53.
L’extrait aqueux de feuille sèche (6,5, 8 et 40 mg/mL) in vitro a inhibé la croissance de Staphylococcus aureus, S. epidermidis et S. typhimurium, méthodes de numération totale sur plaques et de turbidimétrie54. L’extrait aqueux de fruit (6,5 mg/mL) n’a pas exercé d’action significative54. L’extrait aqueux de feuille (1 mg/mL), in vitro, modèle d’iléon isolé de cobaye, a montré une activité spasmolytique55.
L’extrait aqueux (décoction) de feuille (10 mL/kg), par voie orale au rat, a diminué significativement le transit intestinal56.
L’extrait aqueux de feuille fraîche (50, 100, 200 et 400 mg/kg) par voie orale au rat et à la souris des deux sexes, en groupes de 6, avec diarrhée provoquée par l’huile de Castor (3 mL/kg), a diminué significativement de façon dose-dépendante le transit intestinal et les signes de diarrhée57.
L’extrait aqueux (décoction) de feuille, 10-20 g/j selon l’âge, par voie orale à 31 hommes (âgés de 1 à 18 ans) atteints de diarrhée causée par un rotavirus, a diminué significativement le temps du traitement avec une relation entre le témoin ayant reçu un autre traitement (décoction Gegen Qinlian) dans un essai clinique aléatoire et en double aveugle58.
La feuille en capsules de 500 mg, (standardisation de flavonoïdes, quercétine 1 mg/500 mg), par voie orale (1 capsule chaque 8 heures durant 3 jours), à des patients adultes atteints de diarrhée aiguë, a diminué significativement la durée des douleurs abdominales dans un essai clinique aléatoire en double-aveugle59. Les extraits aqueux et méthanolique d’écorce (45 mg/mL, 0,1 mL/plaque) in vitro ont été actifs contre Staphyllococcus aureus et Escherichia coli60.
L’extrait aqueux (décoction) d’écorce de tige in vitro a été actif contre Entamoeba histolytica avec une CIM < 10 μg/ mL. Le même extrait, à concentration de 80 μg/ mL a inhibé à plus de 70% les contractions d’iléon isolé de cobaye en bain d’organe provoquées par l’acéthylcholine et/ou le chlorure de potassium61.
Toxicité
Travaux TRAMIL62-63
L’extrait aqueux (0,012, 0,127, 0,636 et 1,273 mg/mL) et celui hexanique (0,053, 0,265 et 0,53 mg/mL) de feuille séchée in vitro sur le modèle d’induction de ségrégation somatique à court terme sur Aspergillus nidulans n’ont pas montré d’effet génotoxique.
Travail TRAMIL62
La feuille séchée en poudre, dose unique (0,5; 1 et 2 g/ kg) par voie orale à la souris, selon le modèle d’induction de micronoyaux dans la moelle osseuse, n’a pas eu d’effet génotoxique.
Travail TRAMIL64
La DL50 de feuille séchée, en poudre par voie orale à la souris, a été supérieure à 2 g/kg.
Travail TRAMIL65
La feuille séchée en poudre, dose unique (2 g/kg) par voie orale au rat, n’a pas provoqué la mort ni de signes évidents de toxicité pendant les 14 jours d’observation et n’a pas mis en évidence de changement lors des études histopathologiques.
Travail TRAMIL66
L’extrait aqueux (décoction à 50%) de feuille fraîche (906 mg/kg/24 h pendant 5 jours), par voie orale au rat Wistar (10 animaux par groupe, 5 de chaque sexe), groupe témoin constitué de 6 autres rats de même caractéristiques (3 de chaque sexe) a reçu de l’eau distillée, modèle de toxicité à dose répétée du LEBi, observés constamment les 12 premières heures puis chaque 24 heures durant 14 jours. L’extrait n’a pas provoqué de mortalité ni aucun signe de toxicité excepté une diminution de poids transitoire la première semaine pour une femelle. L’autopsie n’a montré aucune lésion organique de sorte que l’extrait étudié ne présente aucune toxicité dans cet essai.
Travail TRAMIL67
L’extrait aqueux (décoction à 4,78%) lyophilisé d’écorce de tige fraîche, à concentration de 333,33 mg/mL d’eau, (1 g/kg/jour) par voie orale à la souris Hsd:ICR de 27,14 ± 2,69 g (9 mâles et 9 femelles) durant 5 jours consécutifs suivis de 12 jours d’observation, n’a pas provoqué de mortalité ni aucun signe de toxicité, selon le protocole EPA.OPPTS.870.3100. Le groupe témoin constitué de 10 souris de mêmes caractéristiques a reçu de l’eau (0,3 mL/20 g de poids corporel). Aucun signe de toxicité n’a été mis en évidence (Test polydimensionnel de Irwing), ni aucun changements n’ont été observés dans le poids corporel par rapport aux normales da la courbe de croissance. L’autopsie n’a montré aucune altération macroscopique des organes.
Travail TRAMIL68
L’extrait aqueux (décoction à 4,42%) lyophilisé de feuille fraîche, à concentration de 500 mg/mL d’eau, par voie topique 4 heures par jour pendant 5 jours consécutifs à 3 lapins New Zealand, 0,5 mL en patchs de 5 cm2 sur la peau saine rasée du dos, témoin avec de l’eau du côté opposé du traitement, protocole EPA 870.2500, n’a pas montré ni œdème, ni érythème durant l’essai ni les 11 jours d’observation qui ont suivi.
L’extrait aqueux de feuille sèche (2 g/kg), en dose unique par voie orale au rat et à la souris, n’a pas provoqué de mortalité ni aucun signe évident de toxicité69.
La DL50 de l’extrait aqueux de feuille par voie intrapéritonéale à la souris a été de 1,534 ± 69 mg/kg57.
On ne dispose pas d’information garantissant l’innocuité de son emploi médicinal avec des enfants, ni avec des femmes enceintes ou allaitantes.
Préparation et dosage
Le fruit de Psidium guajava constitue un aliment de consommation humaine relativement répandu.
Contre les crises de nerfs, la diarrhée, l’état éthylique (gueule de bois) ou les vomissements :
Préparer une décoction ou une infusion avec 30 grammes de feuilles, de boutons ou pousses foliaires dans 4 tasses (1 litre) d’eau. Pour la décoction, faire bouillir pendant 5 minutes, dans un récipient couvert. Pour l’infusion, verser l’eau bouillante sur les 30 grammes de feuille, de boutons ou pousses foliaires avant de couvrir. Laisser reposer, ajouter éventuellement une demi petite cuillère (3,5 grammes) de sel et 4 (20 grammes) de sucre, filtrer et boire 1 tasse 3-4 fois par jour.
Contre les éruptions cutanées :
Laver soigneusement un rameau ou des feuilles. Préparer une décoction avec 4-5 cuillerées (30 grammes) de rameau ou de feuilles fraîches dans 4 tasses (1 litre) d’eau, faire bouillir pendant 5 minutes, dans un récipient ouvert. Laisser refroidir et filtrer. Laver la lésion avec de l’eau bouillie et du savon, appliquer la préparation sous forme de bains, lavages ou de compresses sur la zone affectée 3 fois par jour.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- HERRERA J, 1994 Encuesta TRAMIL (Costa atlántica). Laboratorio de fitofarmacología, Departamento de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
- EDOUARD JA, 1992 Enquête TRAMIL. Lycée agricole, Baie-Mahault, Guadeloupe.
- WENIGER B, ROUZIER M, 1986 Enquête TRAMIL. Service Oecuménique d’Entraide SOE, Port au Prince, Haïti.
- WENIGER B, 1987-88 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- GIRON L, 1988 Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
- DELENS M, 1990-92 Encuesta TRAMIL. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
- DELAIGUE J, 2005 TRAMIL survey. PRDI, Tobago House of Assembly, Scarborough, Tobago.
- CHARLES C, 1988 TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
- SOLIS PN, ESPINOSA A, DE GRACIA J, MARTINEZ L, GUPTA MP, 2003 Encuesta TRAMIL (Emberá-Wounaann). Centro de Investigaciones Farmacognósticas de la Flora Panameña, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
- BALZ E, BOYER A, BURAUD M, 2007 Enquête TRAMIL à Marie-Galante. U. Bordeaux 3, U. Paris XI Chatenay- Malabry, UAG, Guadeloupe.
- BOYER A, BURAUD M, 2007 Enquête TRAMIL à La Désirade. U. Paris XI Chatenay-Malabry, UAG, Guadeloupe.
- BOULOGNE I, 2009 Enquête TRAMIL, (Terre-de-Bas et Terre-de-Haut) Les Saintes, UAG, Guadeloupe (FWI).
- LONGUEFOSSE JL, NOSSIN E, 1990-95 Enquête TRAMIL. Association pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
- MARCELLE G, 1996 TRAMIL survey. Produce chemist laboratory, Ministry of Agriculture, St George’s, Grenada.
- MARTINEZ M, HERNANDEZ O, HERNANDEZ J, SARMIENTO E, 2003 Encuesta TRAMIL Guajiquiro, La Paz. Laboratorio de Histolología Vegetal y Etnobotánica, Dep. de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
- MARTINEZ M, MEDINA D, SUANSIN G, SARMIENTO E, 2003 Encuesta TRAMIL Las Marías, Gracias a Dios. Laboratorio de Histolología Vegetal y Etnobotánica, Dep. de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
- HENDERSON C, KRISHNARAYAN V, CASTILLO J, 1996 TRAMIL survey. Belize Enterprise for Sustainable Technology BEST, Belmopan, Belize.
- MOREJON Z, LOPEZ M, GARCIA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORON F, BOULOGNE I, ROBINEAU L, 2009 Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Cuba.
- MENDEZ M, MEDINA ML, DURAN R, 1996 Encuesta TRAMIL. Unidad de recursos naturales, Centro de Investigación Científica de Yucatán CICY, Mérida, México.
- SOLIS PN, OLMEDO D, BUITRAGO DE TELLO RE, GUPTA MP, 2000 Estudio fitoquímico y toxicológico de algunas plantas TRAMIL. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
- WILSON CW, SHAW PE, 1978 Terpene hydrocarbons from Psidium guajava. Phytochemistry 17:1435- 1436.
- MACLEOD AJ, DE TROCONIS NG, 1982 Volatile flavour components of guava. Phytochemistry 21(6):1339- 1342.
- MISRA K, SESHADRI TR, 1968 Chemical components of the fruits of Psidium guajava. Phytochemistry 7(4):641-645.
- CHIANG H, LEE S, GUO S, 1986 Active principles of hypoglycemic effect from Psidium guajava. Part II. Asian J Pharm Suppl 6(8):58.
- VARSHNEY I, BADHWAR G, KHAN A, SHRIVASTAVA A, 1971 Saponins and sapogenins of Sesbania grandiflora seeds, Albizzia lebbek pods and Psidium guajava fruits. Indian J Appl Chem 34(5):214-216.
- BASSOLS F, DEMOLE EP, 1994 The occurrence of pentane-2-thiol in guava fruit. J Essent Oil Res 6(5):481-483.
- LOWRY JB, 1968 The distribution and potential taxonomic value of alkylated ellagic acids. Phytochemistry 7(10):1803-1813.
- DAVIS P, MUNROE K, SELHIME A, 1976 Laboratory Proc Fla State Hort Soc bioassay of volatile naturally occurring compounds against the Caribbean fruit fly. p174.
- MAIR AGR, PANDIYAN M, VENKASUBRAMANIAN H, 1987 Polyphenolic compounds from flowers of Psidium guajava. Fitoterapia 58(3):204-205.
- SESHADRI TR, VASISHTA K, 1965 Polyphenols of the leaves of Psidium guava-quercetin, guaijaverin, leucocyanidin and amritoside. Phytochemistry 4(6):989-992.
- GRIFFITHS LA, 1959 On the distribution of gentisic acid in green plants. J Exp Biol 10(3):437- 442.
- KAKIUCHI N, HATTORI M, NAMBA T, NISHIZAWA M, YAMAGISHI T, OKUDA T, 1985 Inhibitory effect of tannins on reverse transcriptase from RNA tumor virus. J Nat Prod 48(4):614-621.
- LOZOYA X, MECKES M, ABOU-AAID M, TORTORIELLO J, NOZZOLILLO C, ARNASON J, 1994 Quercetin glycosides in Psidium guajava L. leaves and determination of a spasmolytic principle. Arch Med Res 25(1):11-15.
- OKUDA T, HATANO T, YAZAKI K, 1984 Guavin B, an ellagitannin of novel type. Chem Pharm Bull 32(9):3787- 3788.
- LUTTERODT GD, 1989 Inhibition of gastrointestinal release of acetylcholine by quercetin as a possible mode of action of Psidium guajava leaf extracts in the treatment of acute diarrhoeal disease. J Ethnopharmacol 25(3):235-247.
- OKUDA T, YOSHIDA T, HATANO T, YAZAKI K, ASHIDA M, 1982 Tannins and related compounds in Myrtaceae. Ellagitannins of the Casuarinaceae, Stachyuraceae and Myrtaceae. Phytochemistry 21:2871-2874.
- OKUDA T, YOSHIDA T, HATANO T, YAZAKI K, IKEGAMI Y, SHINGU T, 1987 Guavins A, C and D, complex tannins from Psidium guajava. Chem Pharm Bull 35(1):443-446.
- OSMAN AM, YOUNES ME, SHETA AE, 1974 Triterpenoids of the leaves of Psidium guajava. Phytochemistry 13(9):2015-2016.
- OSMAN A, EL-GARBY Y, SHETA A, 1975 Chemical examination of local plants part. VII. Psidium guajava leaf extracts. Egypt J Chem 18:347.
- DUKE JA, ATCHLEY AA, 1986 Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p136.
- ECHEMENDIA C, MORON F, 1997 Efecto antidiarreico de la tintura al 20% de hojas de Psidium guajava (guayaba), en pacientes con diarrea aguda simple en atención primaria de salud. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- ECHEMENDIA C, 1997 Efecto antidiarreico de la tintura al 20% de hojas de Psidium guajava (guayaba), en pacientes con diarrea aguda simple en atención primaria de salud (Tesis de Maestría). Universidad Médica de La Habana, Cuba.
- GUPTA M, ESPOSITO AVELLA M, 1988 Evaluación química y farmacológica de algunas plantas medicinales de TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panameña CIFLORPAN, Facultad de Farmacia, Universidad de Panamá, Panamá, Panamá.
- MORON F, MARTINEZ MC, MORON D, 1999 Disminución del tránsito intestinal en ratones por tintura de guayaba (Psidium guajava L.) oral. Rev Cubana Planta Med 4(2):54-56.
- PAZOS L, QUIROS S, GONZALEZ S, 2006 Transito intestinal, en ratón, del extracto de la corteza fresca de Psidium guajava. Trabajo TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
- WEI-WEI ZHANG, YAN LI, XUE-QING WANG, FENG TIAN, HONG CAO, MIN-WEI WANG, QI-SHI SUN, 2005 Effects of magnolol and honokiol derived from traditional Chinese herbal remedies on gastrointestinal movement. World J Gastroenterol 11(28):4414-4418.
- MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BOUCOURT E, MORON F, 2000 Actividad antimicrobiana in vitro de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010 Evaluación de la actividad antimicrobiana del extracto acuoso de la corteza del tallo fresco Psidium guajava L.Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- BOUCOURT E, MARTINEZ M J, MOREJON Z, 2010 Evaluación de la actividad antimicrobiana del extracto acuoso de la hojas frescas Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- BIRDI T, DASWANI P, BRIJESH S, TETALI P, NATU A, ANTIA1 N, 2010 Newer insights into the mechanism of action of Psidium guajava L. leaves in infectious diarrhoea. BMC Complementary and Alternative Medicine 10:33 www.biomedcentral.com/1472-6882/10/33
- MISA C, HERNANDEZ N, ABRAHAM A, 1979 Contribution to the biological evaluation of Cuban plants. I. Rev Cubana Med Trop 31:5-12.
- CACERES A, JAUREGUI E, HERRERA D, LOGEMANN H, 1991 Plants used in Guatemala for the treatment of dermatomucosal infections. 1: Screening of 38 plant extracts for anticandidal activity. J Ethnopharmacol 33(3):277-283.
- GNAN SO, DEMELLO MT, 1999 Inhibition of Staphylococcus aureus by aqueous goiaba extracts. J Ethnopharmacology 68(1-3):103-108.
- LOZOYA X, BECERRIL G, MARTINEZ M, 1990 Intraluminal perfusion model of in vitro guinea pig ileum as a model of study of the antidiarrheic properties of guava (Psidium guajava). Arch Invest Med (Mex) 21:155-162.
- LUTTERODT G, 1992 Inhibition of microlax-induced experimental diarrhea with narcotic-like extracts of Psidium guajava leaf in rats. J Ethnopharmacol 37(2):151- 157.
- OJEWOLE JA, AWE EO, CHIWORORO WD, 2008 Antidiarrhoeal activity of Psidium guajava Linn. (Myrtaceae) leaf aqueous extract in rodents. J Smooth Muscle Res 44(6):195-207.
- WEI L, LI Z, CHEN B, 2000 Clinical study on treatment of infantile rotaviral enteritis with Psidium guajava L. Zhongguo Zhong Xi Yi Jie He Za Zhi 20(12):893-895.
- LOZOYA X, REYES H, CHAVEZ MA, MARTINEZ MC, SOTO Y, DOUBOVA SV, 2002 Intestinal anti-spasmodic effect of a phytodrug of Psidium guajava folia in the treatment of acute diarrheic disease. J Ethnopharmacol 83(1- 2):19-24.
- ABDELRAHIM SI, ALMAGBOUL AZ, OMER ME, ELEGAMI A, 2002 Antimicrobial activity of Psidium guajava L. Fitoterapia 73(7-8):713-715.
- TONA L, KAMBU K, NGIMBI N, MESIA K, PENGE O, LUSAKIBANZA M, CIMANGA K, DE BRUYNE T, APERS S, TOTTE J, PIETERS L, VLIETINCK AJ, 2000 Antiamoebic and spasmolytic activities of extracts from some antidiarrhoeal traditional preparations used in Kinshasa, Congo. Phytomedicine 7(1):31-38.
- MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BOUCOURT E, MORON F, 2000 Actividad genotóxica in vitro de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- BETANCOURT J, RAMOS A, VIZOSO A, MARTÍNEZ MJ, LOPEZ M, 2000 Ausencia de actividad genotóxica del extracto fluido de Psidium guajava L (guayaba) evaluada en un sistema de ensayo de Aspergillus nidulans. Rev Cubana Planta Med 5(2):38-40.
- MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BARCELO H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORON F, 2000 Toxicidad aguda clásica de hoja de Psidium guajava L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, BARCELO H, LAINEZ A, MONTES ME, REGO R, BOUCOURT E, MORON F, 2000 Toxicidad aguda de hoja de Psidium guajava L. en el modelo de clases tóxicas agudas. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- LOPEZ M, MOREJON Z, MARTINEZ MJ, BACALLAO Y, FUENTES V, 2009 Toxicidad aguda oral a dosis repetidas de decocción al 50% de hojas frescas de Psidium guajava L. Investigación TRAMIL. Facultad de Ciencias Médicas “Dr. Salvador Allende”, Laboratorio Central de Farmacología, La Habana, Cuba.
- PAZOS L, COTO T, GONZALEZ S, 2006 Toxicidad oral aguda dosis repetida, en ratón, del extracto de la corteza fresca de Psidium guajava. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
- PAZOS L, COTO T, GONZALEZ S, 2006 Irritabilidad dérmica, piel sana en conejos, de hoja por decocción de Psidum guajava. Informe TRAMIL. Laboratorio de Ensayos Biológicos, LEBi, Universidad de Costa Rica, San Pedro, Costa Rica.
- PEREZ GUTIERREZ RM, MITCHELL S, VARGAS SOLIS R, 2008 Psidium guajava: A review of its traditional uses, phytochemistry and pharmacology. J Ethnopharmacol 117(1):1-27.