Anamafana ou Anamalaho (Pharmacopée malagasy)
[218]
Sommaire
Nom scientifique : Spilanthes acmella Murr. (Composées).
- Nom accepté : Acmella oleracea
Autre nom malagasy : Kimotodoha (Betsil.).
Noms français et créole : Cresson de Para, Cresson de l'île de France, Spilanthe potager, Brède mafane.
(Anglais : Para cress ; allemand : Parakresse ; portugais : Agriao de Para, Jambu).
Description
Le genre Spilanthes Linné est caractérisé par ses capitules hétérogames, radiés, à fleurs externes femelles (par avortement des étamines), les autres fleurs du disque étant hermaphrodites, les unes et les autres fertiles ; dans les formes cultivées (Anamalahobe en malagasy), les capitules deviennent souvent homogames, toutes les fleurs étant hermaphrodites. Involucre court, campanulé, à bractées disposées en deux séries (avec des formes intermédiaires), les externes membraneuses-herbacées, les internes plus molles, indurées à la base seulement. Réceptacle convexe, en coupole ou subconique : ce dernier type surtout chez les formes sauvages : Anamalahokely ; pourvu de petites paillettes embrassant les fleurs du disque, souvent adhérentes à la base de l'ovaire ou adnées au stipe très court qui le porte.
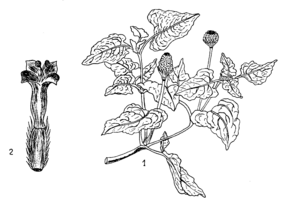
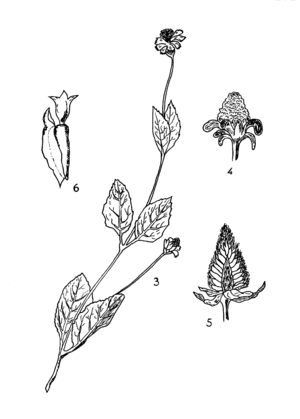
On a souvent considéré comme deux espèces distinctes l’Anamalahokely ou Anamalahonkova qui peut être identifié à Spilanthes acmella Murray et l’Anamalahobe ou Anamalahombazaha qu'on distinguait sous le nom de Spilanthes oleracea Clarke. Humbert les considère, justement pensons-nous, comme deux variétés d'une même espèce : la première étant la forme sauvage et la seconde la forme améliorée par la culture (voir figures 34 et 35).
L’Anamalahokely est une herbe annuelle, à tiges rampantes et radicantes à la base, ascendantes plus haut (atteignant 10 à 40 centimètres de long), glabre ou très lâchement pubescente. Feuilles opposées à limbe entier, ovale, aigu au sommet, arrondi ou plus ou moins contracté à la base (de 20 à 30 millimètres de long et 12 à 20 millimètres de large), à trois nervures principales, à bords dentés ou seulement serrulés. Pétiole atteignant le quart de la longueur du limbe. Entre-nœuds toujours plus longs que les feuilles. Capitules solitaires, terminaux ou axillaires,
[219]
[220]
portés par de longs pédoncules nus (2 ou 3 fois plus longs que les feuilles axillantes). Capitules hétérogames à fleurs femelles externes ligulées en petit nombre, à ligule petite et peu visible, jaune ou brun clair.
L’Anamalahobe est une plante plus trapue, dont les entre-nœuds dépassent rarement la longueur des feuilles. Feuilles plus grandes, à limbe toujours contracté à la base et à bords ondulés plutôt que dentés. Capitules homogames, toutes les fleurs étant hermaphrodites et à corolle en tube à quatre segments (pas de fleurs ligulées). Réceptacle ovoïde ou en coupole, à paillettes non adnées au stipe de l'ovaire. Espèce d'origine américaine, devenue cosmopolite dans toutes les régions chaudes du globe. La forme sauvage est répandue dans toutes les régions de Madagascar, souvent rudérale, poussant au bord des chemins ou sur les terrains cultivés. La forme cultivée est bien connue comme espèce potagère et vendue sur tous les marchés (D. Bois dans son ouvrage : Les Plantes Alimentaires chez tous les Peuples et à travers les âges, Paris, 1928, signale que le R.P. Camboué lui avait envoyé des graines de cette espèce).
Bibliographie botanique
Linné, Mant. (1771), p. 475.
Murray, Syst., 13e édit. (1797), p. 610.
Clarke, Composit. Ind. (1876), p. 138.
Baillon, Histoire des Plantes, Tome VIII, p. 48 et fig. 71-72 (sous le nom de Spilanthus).
H. Humbert : Composées, Tome III, Paris, 1963, p. 659-660 et Pl. CXXI, fig. 1 à 6 ; in Humbert, Flore de Madagascar et des Comores.
Valeur alimentaire
Toutes les parties de la plante ont une saveur piquante, brûlante, aromatique et provoquant une certaine sensation d'insensibilisation de la langue et des muqueuses de la bouche. Aussi constitue-t-elle un condiment apprécié. On l'utilise à la préparation traditionnelle du ro-mazava, du vary amin' anana et d'autres plats typiquement malagasy.
« Ny anamalaho dimbin' antsy sy ny akoho tanora dia tena tian' ny Malagasy » (Firaketana, n° 33 (septembre 1939), p. 519).
C'est cette saveur piquante qui fait apprécier l’anamalaho. Mais les navigateurs avaient constaté dès le XVIe siècle que cette plante, consommée en salade, protégeait du scorbut. C'est d'ailleurs pourquoi elle fut transportée, à la faveur des voyages maritimes, dans tous les pays chauds. Sa réputation est telle que dès 1825 Rousseau lui consacre un ouvrage : Histoire Naturelle et Médicale du Cresson de Para.
Unger préconise chaudement sa culture dans le sud des Etats-Unis (Report of the Agricultural Section of the United States Patent office,
[221]
[222]
Washington, 1859, p. 356). Lindley et Moore, dans leur Treasury of Botany, vol. II (1870), p. 1083, confirment aussi sa valeur antiscorbutique.
Étude chimique
C'est à l’acide ascorbique ou vitamine C que le Cresson de Para doit ses propriétés antiscorbutiques (voir la notice consacrée à la Vitamine C).
La saveur brûlante et la sensation d'insensibilité de la langue et des muqueuses de la bouche que l'on ressent après avoir consommé cette plante sont, par contre, dues à une substance azotée appelée spilanthol par Gerber, Archiv der Pharm., 241, 1903, p. 280, qui fut le premier à procéder à son isolement. Les capitules sont la partie la plus riche en spilanthol. D'après M. Jacobson (Chemistry and Industry, London, 1957, p. 50-51), ils en renferment environ 1,25 p. 100 de leurs poids sec. Asano et Kanematsu (Journ. Pharm. Soc. Japan, 544, 1927, p. 521, en anglais) avaient précédemment montré que les formes sauvages, notamment S. acmella var fusca Makino (forme très voisine de l’anamalahokely malagasy) ont les teneurs les plus élevées.
Un grand intérêt a été porté à la structure du spilanthol quand on s'est aperçu qu'il avait des liens étroits de parenté chimique avec la pellitorine, principe actif du Pyréthre (Anacyclus pyrethrum DC). Nous en reparlerons à propos de cette espèce qui a fait l'objet d'une certaine culture à Madagascar. Dès 1932, Asano et ses collaborateurs qui travaillaient au Japon sur la question depuis 1920, suggéraient que le spilanthol était la N-isobutylamide d'un acide 4,6-décadiènoïque, c'est-à-dire que sa formule développée pourrait être écrite, en première approximation, comme suit : CH3-CH2-CH2-CH=CH-CH=CH-CH2-CH2-CO-NH-CH2-CH-(CH3)2.
(Voir Asahina (Y.) et Asano (M.), Journ. Pharm. Soc. Japan, 460, 1920, p. 503, et 480, 1922, p. 85 ; Asano (M.) et Kanematsu (T.) : Ueber die Konstitution des Spilanthols, des scharfen Prinzips der Parakresse, Berichte deutsch. chem. Gesselsch., 65, 1932, p. 1602-1604, en allemand).
Aux Indes, G.S. Pendse et ses collaborateurs reprirent cette étude en 1945. Ainsi qu'une autre équipe, celle de Gokhale et Bhide. Ils confirmèrent les travaux d’Asano et Kanematsu et montrèrent que le spilanthol isolé de la plante était bien responsable de la saveur brûlante et présentait des propriétés paralysantes et insecticides vis-à-vis de la mouche domestique, et surtout des propriétés larvicides comparables à celles du Pyrèthre, bien que moins énergiques (voir Current Science (India), 14, 1945, p. 37 ; Journ. Indian Chem. Soc., 22,1945, p. 250 ; Journal Univ. Bombay, 15 A, 1946, n° 3, p. 26).
M. Jacobson qui, de son côté aux U.S.A., avait extrait le spilanthol d'une autre plante dès 1945 (voir Accree, Jacobson et Haller, Jour. Org. Chem., 10, 1945, p. 449), tentait de réaliser la synthèse de ce corps, et parvenait à la conclusion que le diène conjugué qu'indique son spectre
[223]
U.V. devait avoir la configuration 4, cis-6, trans ou 4, trans-6, cis rour qu'il soit physiologiquement actif (voir M. Jacobson : The synthesis of N-iso-butyl-trans, 4-trans, 6-decadienamide and the structure of spilanthol, Journ. American Chem. Soc., 78, 1956, p. 5084-5086 ; The structure of spilanthol, Chemistry and Industry, 1957, p. 50-51).
T. Yoshioka, qui essayait au Japon, depuis 1954, de réaliser de son côté cette synthèse, y parvenait enfin en 1958 et établissait l'identité, chimique du spilanthol et de la N-isobutylamide de l'acide déca-cis, 4-trans 6-diènoïque.
(Voir T. Yoshioka : Synthesis of Spilanthol ; I- in Journ. Pharm. Soc. Japan, 75, 1955, p. 6o6-6o7 ; II- Journ. Pharm. Soc. Japan, 75, 1955, p. 6o8-6o9 ; III- Annual Report Fac. Pharm. Tokushima Univ., 3, 1954, p. 7-8 ; IV- J. Pharm. Soc. Jap., 75,195 5, p. 622-624 ; V- Yakugaku Zasshi, 78, 1958, p. 258-260, en japonais ; résumé anglais in Chem. Abstracts (U.S.A.), 52, 11740 f).
D'après Jacobson (loc. cit. 1957) le spilanthol naturel, C14 H25 NO, est un liquide d'apparence huileuse, incolore, point d'ébullition sous 0,5 millimètre de mercure : 165° ; point de fusion après cristallisation dans l'éther à basse température : 23° ; nD (25) 1,5135 ; spectre U.V. λ max. 228,5 mμ (∈ : 34000) ; soluble dans le pentane, l'éther de pétrole, l'éther ordinaire, l'essence pour automobile, etc. Ses solutions dans ces divers solvants, exposées à la lumière, sont très rapidement converties en un produit inactif physiologiquement, l'isomère trans, 4-trans, 6 ; point d'ébullition sous 0,25 millimètre : 145° ; point de fusion après cristallisation : 91,5° ; celui-ci se polymérise à son tour rapidement en un produit résineux qui communique à la solution une couleur jaune.
D'après Yoshioka (1958), le spilanthol de synthèse a également l'apparence d'une huile incolore, susceptible de cristalliser lorsque sa solution concentrée dans l'éther de pétrole est évaporée à très basse température : point de fusion pour le produit pur : 58-59° ; point d'ébullition sous 0,1 millimètre : 142-145°; nD (23) 1,5098, spectre U.V. identique à celui du spilanthol naturel. Ce produit a cependant une saveur moins brûlante que le spilanthol naturel et une action paralysante moins marquée sur la mouche. Aussi Yoshioka pense-t-il que le produit naturel doit renfermer de petites quantités d'autres substances qui seraient susceptibles de renforcer son activité physiologique. On sait que c'est très souvent le cas et qu'une purification exagérée des substances naturelles peut souvent leur faire perdre une fraction importante de leur activité.
Gerber, in Archiv der Pharm., 241, 1903, p. 270, avait aussi obtenu par entraînement de vapeur une huile essentielle appelée Parakressenöl. La plante fraîche en renfermerait 0,27 p. 100. C'est une substance huileuse, non azotée, à saveur brûlante, d = 0,847 ; (α)D + 1,85°. Soumise au fractionnement sur colonne de Vigreux elle fournit une fraction passant entre 145 et 155° sous 33 millimètres de mercure à laquelle Gerber a donné le nom de spilanthène. Sa formule brute serait C15 H30 et ce corps doit présenter au moins une double liaison, car il fixe facilement deux
[224]
atomes de brome pour donner un dérivé de formule C15 H28 Br2 ; Il est difficile, étant donnée l'imperfection des techniques de séparation à l'époque, de considérer le spilanthène comme un corps pur. Cependant on peut avancer qu'il s'agit d'un hydrocarbure aliphatique insaturé. Ce spilanthène ne semble pourtant avoir fait l'objet d'aucun travail nouveau depuis 1903. En effet E. Gildemeister et Fr. Hoffmann dans leur ouvrage bien connu : Die aetherischen Oele, Leipzig, 1931, vol. III, p. 968-969, retraçaient ces travaux de Gerber. Dans la nouvelle édition, Berlin, 1961 (Akademie Verlag), tome VII, p. 619-620, ils les citent à nouveau sans rien y ajouter.
R. Pernet in Mémoires Inst. Scient. Madag., VIII, 1957, p. 37, a confondu spilanthène et spilanthol. C'est le spilanthol qui, dans la nomenclature en vigueur dans les années trente était considéré comme l'isobutylamide d'un acide n-nonadiène-carboxylique à la suite des travaux de Asano et Kanematsu (cf. Beilstein E-II-4 (4), p. 639, qui écrit : nonadien (3,5)-carbonsaure-(1)-isobutylamid). Le spilanthène, comme nous l'avons dit, n'est pas une substance azotée et ne peut donc avoir de fonction amide. Il est possible, cependant, qu'il joue un rôle synergique vis-à-vis du spilanthol et son étude chimique mériterait d'être reprise.
Propriétés pharmacologiques
Activité antiscorbutique : nous avons vu qu'elle est confirmée par les dosages de vitamine C. Toutefois la cuisson de la plante, surtout si elle est prolongée, lui fait perdre la majeure partie de ses propriétés. La consommation de la plante crue, en salade, ou tout simplement avec du sel, comme le font d'ailleurs d'eux-mêmes beaucoup d'enfants de Tananarive, est bien plus recommandable, à condition qu'on ait pris les précautions voulues pour éviter la contamination par des parasites intestinaux (arrosage à l'eau propre, clôture des potagers pour interdire aux animaux de venir y déféquer, etc.). Au besoin, on peut désinfecter avant de faire la salade, en lavant rapidement la plante avec une solution de permanganate de potassium à 1 p. 1000.
Si les cas de scorbut proprement dit sont fort rares de nos jours, il existe souvent, par contre, des carences frustes en vitamine C qui se traduisent chez les enfants par des rhumes à répétition. Aussi l'expression proverbiale : « Sery vitan' anamalaho » est elle pleinement justifiée.
Activité odontalgique : L'extrait éthéré de capitules d’anamalaho (pour la préparation duquel on préférera les capitules d’anamalahokely), est un excellent odontalgique qui mériterait d'être employé plus fréquemment en stomatologie.
Sa préparation ne présente aucune difficulté particulière. Les capitules doivent être bien desséchés et sont ensuite épuisés par l'éther ordinaire ou l'éther de pétrole. La seule précaution à prendre est évidemment d'éviter que ne se dégagent des vapeurs de ces solvants très volatils, qui sont non seulement très inflammables, mais constituent encore avec
[225]
l'air des mélanges détonants. On devra utiliser des appareils bien clos, fermant hermétiquement, travailler dans des locaux bien aérés, réfrigérés ou maintenus à température aussi basse que possible, et en l'absence de toute flamme apparente (utiliser des chauffe-ballons électriques).
L'extrait éthéré d’anamalaho peut également être utilisé à la manière du cachou (voir Cachou) pour l'aromatisation de certaines préparations pharmaceutiques.
Emplois comme insecticide : Cet extrait éthéré a des propriétés paralysantes vis-à-vis des mouches domestiques qu'il tue rapidement lorsqu'il est pulvérisé en brouillard à leur contact, dans un solvant approprié. Il est surtout très efficace vis-à-vis des larves de mouches. Vis-à-vis des insectes adultes, son efficacité paraît quelque peu inférieure à celle du pyrèthre (voir Pyrèthre).
Indications thérapeutiques et posologie
A la Pharmacopeia dos Estados Unidos do Brazil, Sao Paolo, 1926, le Cresson de Para (Agriao de Para) est inscrit comme drogue galénique (p. 57-58) et comme base d'une teinture composée (Tintura de Agriao de Para composta, p. 897).
Une teinture analogue a été commercialisée en France récemment encore sous le nom de « Paraguay Roux », comme le rappelle « La Nouvelle Officine » de Dorvault, Paris, 195 5, tome II, p. 449.
Le même ouvrage donne une autre formule qui nous paraît plus efficace :
| grammes | |
| Capitules de Cresson de Para secs | 200 |
| Racines de Pyrèthre | 100 |
| Alcool à 90° | 400 |
Inciser les plantes ; y ajouter l'alcool dans un récipient bien clos ; faire macérer trois jours ; filtrer avec expression. Conserver à l'abri de la lumière.
Cette alcoolature composée est un excellent odontalgique.
Pour supprimer ou soulager les douleurs des caries dentaires, en imbiber un morceau de coton hydrophile ou un fragment de tissu propre et l'introduire dans la dent cariée.
On peut l'employer également après les soins dentaires : XV à XX gouttes dans un verre d'eau, comme rince-bouche.
L. Beille, Botanique Pharmaceutique, Paris, 1909 (Maloine Edit.), tome II, p. 453, recommande cette alcoolature, ou l'alcoolature simple de Cresson de Para préparée dans les mêmes conditions, à raison de 5 à 10 grammes par jour, au moment des repas, comme digestif et pour réduire les douleurs d'estomac.