Hordeum vulgare (PROTA)
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Stimulant | |
| Médicinal | |
| Fourrage | |
| Fibre | |
| Sécurité alimentaire | |
- Protologue: Sp. pl. 1 : 84 (1753).
- Famille: Poaceae (Gramineae)
- Nombre de chromosomes: 2n = 14
Synonymes
- Hordeum sativum Jess. (1863).
Noms vernaculaires
- Orge (Fr).
- Barley (En).
- Cevada (Po).
- Shayiri (Sw).
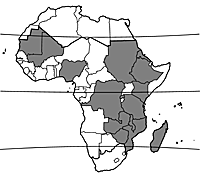
Origine et répartition géographique
L’orge a été domestiquée en Asie occidentale avant 7000 av. J.-C. Sa culture s’est répandue dans le nord de l’Afrique et a remonté le Nil jusqu’à atteindre l’Ethiopie, où elle est devenue l’une des céréales les plus importantes. On ne sait pas exactement quand l’orge est arrivée en Ethiopie, mais cela fait au moins 5000 ans qu’elle y est cultivée. L’orge a gagné le sud de l’Espagne vers 4000–5000 av. J.-C. et elle a atteint l’Europe du Nord et centrale, ainsi que l’Inde, vers 2000–3000 av. J.-C. En Chine, elle est arrivée en 1000–2000 av. J.-C. Au Sahara, elle était cultivée dans les oasis en 100–300 av. J.-C., mais il semble qu’elle n’ait pas migré plus au sud en Afrique de l’Ouest avant le XVIe siècle après J.-C. Christophe Colomb l’a introduite dans le Nouveau Monde. De nos jours, c’est la céréale dont l’aire de culture couvre les zones écologiques les plus diverses, depuis 70°N en Norvège jusqu’à 44°S en Nouvelle-Zélande. En Ethiopie, au Tibet et dans les Andes, sa culture se pratique sur les flancs des montagnes à des altitudes bien supérieures à celles des autres céréales. Pour ce qui est de l’Afrique tropicale, on la trouve surtout en Afrique de l’Est. En Afrique de l’Ouest, l’orge est une culture de saison froide du Sahel et du nord du Nigeria. A Madagascar, elle se cultive pendant la saison sèche.
Usages
A l’échelle mondiale et par ordre d’importance, l’orge est utilisée en alimentation du bétail, pour le maltage (notamment en brasserie) et en alimentation humaine. Dans les régions tropicales et subtropicales, c’est surtout pour l’alimentation humaine qu’elle est produite. En Ethiopie et en Erythrée, la plus grande partie de l’orge en grains sert à confectionner un pain local (“injera”), qui ressemble à une crêpe ; mais on en fait aussi bien des bouillies et des soupes que des boissons de ménage, alcoolisées ou non. Au Kenya et en Tanzanie, elle a surtout une importance en brasserie. Grillés ou sautés, ses grains se dégustent en amuse-gueule, particulièrement lors des festivités.
La paille d’orge sert de nourriture et de litière aux animaux domestiques ainsi que de matériau de couverture pour les huttes. L’orge peut être pâturée pendant le tallage, ou fauchée avant maturité et donnée directement aux animaux, ou encore ensilée. Dans les régions tempérées, les grains d’orge sont également donnés aux animaux. Les sous-produits du brassage entrent aussi dans l’alimentation du bétail.
Production et commerce international
La production mondiale annuelle d’orge se monte à 136 millions de t de grains (moyenne de 1999–2003) sur 54 millions d’ha. Les principaux pays producteurs sont la Fédération de Russie, l’Allemagne et le Canada, qui produisent respectivement 16,2, 12,1 et 11,4 millions de t par an. En Afrique tropicale, le principal producteur d’orge est l’Ethiopie, avec 950 000 t de grain sur 870 000 ha entre 1999–2003, suivie par le Kenya (45 000 t sur 20 000 ha) et l’Erythrée (24 000 t sur 44 000 ha). En Ethiopie et en Erythrée, l’orge est produite principalement pour la subsistance, et en Ethiopie, la part de l’orge de brasserie ne représente que 2% de la production totale. De petites superficies (moins de 4000 ha) sont cultivées en Mauritanie, en R.D. du Congo, en Tanzanie, en Zambie et au Zimbabwe. La plus grande partie de l’orge produite est consommée au niveau national, et seuls 20 millions de t par an sont entrés dans le commerce international dans la période 1998–2002. Les plus gros exportateurs sont l’Union européenne, l’Australie et le Canada ; l’Arabie saoudite, la Chine et le Japon sont les plus gros importateurs. En 1998–2002, les principaux importateurs en Afrique tropicale étaient le Zimbabwe et l’Ethiopie, dont la moyenne annuelle s’élevait à 8000 t pour l’un et 3000 t pour l’autre.
Propriétés
La composition de l’orge, par 100 g de partie comestible, est de : eau 9,4 g, énergie 1482 kJ (354 kcal), protéines 12,5 g, lipides 2,3 g, glucides 73,5 g, fibres alimentaires 17,3 g, Ca 33 mg, Mg 133 mg, P 264 mg, Fe 3,6 mg, Zn 2,8 mg, vitamine A 22 UI, thiamine 0,65 mg, riboflavine 0,29 mg, niacine 4,6 mg, vitamine B6 0,32 mg, folates 19 μg et acide ascorbique 0 mg. La composition en acides aminés essentiels, par 100 g de partie comestible, est de : tryptophane 208 mg, lysine 465 mg, méthionine 240 mg, phénylalanine 700 mg, thréonine 424 mg, valine 612 mg, leucine 848 mg et isoleucine 456 mg. Les principaux acides gras, par 100 g de partie comestible, sont : acide linoléique 999 mg, acide palmitique 411 mg, acide oléique 241 mg et acide linolénique 110 mg (USDA, 2004). On ne peut pas employer d’orge pour fabriquer du pain levé en raison de sa faible teneur en gluten. La teneur relativement élevée en fibres alimentaires présente un intérêt sur le plan nutritionnel, car il est prouvé que l’augmentation de ces fibres aide à lutter contre le diabète, l’hyperlipidémie, l’obésité, l’hypertension, les maladies coronariennes et divers troubles gastro-intestinaux. Si l’orge est préférée au blé et au seigle pour le maltage, c’est en raison de ses lemmes et paléoles scellées, qui protègent la jeune plumule pendant la germination, donnent un grain plus ferme à la teneur en humidité élevée nécessaire à la macération et au maltage, et facilitent le filtrage.
Description
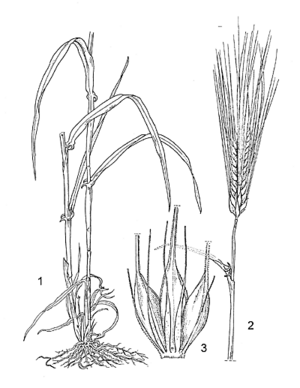
- Graminée annuelle atteignant 120(–150) cm de haut, tallant abondamment ; système racinaire constitué de 3–9 racines primaires et de racines adventives ; tige (chaume) habituellement érigée.
- Feuilles 5–10 par chaume, alternes, simples ; gaine glabre, à grandes auricules qui se chevauchent à l’apex ; ligule de 1–3 mm de long, hyaline, ciliée ; limbe linéaire-lancéolé, de 5–40 cm × 0,5–1,5 cm.
- Inflorescence : épi terminal cylindrique de 5–10(–30) cm de long, composé de groupes de 3 épillets disposés de façon alterne.
- Epillets à 1 fleur, celle-ci étant bisexuée ; glumes étroites, faisant environ la moitié de la longueur de la lemme, garnies de fines soies à l’extrémité ; lemme ovale, de 9–11 mm × 3 mm, à 5 nervures, se terminant habituellement en une arête pouvant atteindre 15 cm de long ; paléole aussi longue que la lemme, sans arête ; étamines 3 ; ovaire supère, à 2 stigmates.
- Fruit : caryopse (grain), ellipsoïde, aplati et cannelé d’un côté, de taille variable selon le cultivar, poilu à l’extrémité.
Autres données botaniques
Le genre Hordeum comprend 32 espèces. Les hybrides issus de croisements de Hordeum vulgare avec d’autres espèces de Hordeum sont stériles ou présentent des anomalies. La grande variabilité de l’orge a conduit dans le passé à distinguer de nombreuses espèces. Aujourd’hui, on s’accorde pour dire qu’une seule espèce, Hordeum vulgare, est impliquée dans l’évolution de l’orge, qui forme un complexe de plantes cultivées et d’adventices, dans lequel l’orge cultivée a évolué à partir de populations sauvages. On obtient facilement des hybrides fertiles entre les types sauvages et cultivés et ils apparaissent naturellement là où les deux parents croissent côte à côte. L’orge sauvage a été classée comme subsp. spontaneum (C.Koch) Thell. (synonyme : Hordeum spontaneum C.Koch), répartie en Afrique du Nord, à l’est de la Méditerranée et en Asie occidentale ; les types cultivés ont été classés quant à eux dans la subsp. vulgare.
La variabilité de l’orge cultivée est immense, avec des milliers de variétés-populations et des centaines de cultivars. Les cultivars peuvent être distingués en fonction du nombre de rangs de grains (2 ou 6), de l’aspect des épis (lâche ou compact), ou de la présence ou absence d’arêtes sur les lemmes. Tous les types sauvages possèdent des épis à deux rangs, ce qui signifie que sur les 3 épillets situés à chaque nœud, les deux latéraux sont stériles et seul celui du milieu forme une graine. La domestication a donné naissance à des types à 6 rangs où chacun des 3 épillets produit des grains. Ici, 2 gènes interviennent, chacun présentant une série d’allèles multiples ; mais une seule mutation récessive suffit pour qu’un type à 2 rangs se transforme en type à 6 rangs. Les cultivars d’Afrique de l’Ouest sont à 6 rangs, mais en Ethiopie (surtout dans les plus hautes terres) on trouve un type d’ “orge irrégulière”, à 2 rangs pleins et les autres partiellement développés. Chez l’orge vêtue, la lemme et la paléole adhèrent au grain lors du battage, tandis que chez l’orge nue, le grain s’en libère. C’est un unique gène récessif qui détermine ce caractère. En fonction des besoins de vernalisation, on classe l’orge en types d’hiver et de printemps.
Croissance et développement
La plantule lève en 5–6 jours après la germination. Des talles sont produites sur la pousse principale jusqu’à l’initiation florale. Le nombre de talles par plante est influencé par la densité de plantation, le cultivar et les facteurs du milieu : une seule plante forme généralement 1–6 tiges, mais de faibles densités peuvent multiplier plusieurs fois ce nombre. Le moment de l’initiation florale varie selon le cultivar, mais en général l’orge fleurit plus tôt que le blé. Espèce de jours longs à réaction quantitative, l’orge fleurit plus tôt lorsque la photopériode est plus longue ; mais la sensibilité photopériodique diffère d’un cultivar à l’autre, allant de très sensible à pratiquement insensible. Les fleurs s’autofécondent largement, mais la pollinisation croisée peut atteindre les 10%. Le grain mûrit en 20–40 jours. L’orge peut mûrir dans une courte saison de 3–4 mois, ce qui est moins long que la durée requise pour les autres céréales importantes.
Ecologie
L’orge croît sous des conditions de photopériode, de température et de précipitations très variables, mais elle est mieux adaptée aux climats tempérés. Elle supporte les températures élevées sous des climats secs et l’humidité sous des climats frais, mais elle est mal adaptée aux climats chauds et humides, avant tout en raison de sa sensibilité aux maladies. En Ethiopie, on trouve de l’orge à 1500–3500 m d’altitude, mais elle est surtout cultivée entre 2000 m et 3000 m. Au Kenya, elle est cultivée à 1500–3000 m d’altitude.
L’orge d’hiver nécessite une vernalisation par une période de basses températures (de 3–12°C). L’orge est adaptée à des précipitations annuelles allant de 200 mm à plus de 1000 mm. Elle échappe à la sécheresse, en raison de sa maturité précoce, davantage qu’elle ne la tolère.
Ce sont les limons ou les sols légèrement argileux bien drainés et fertiles qui conviennent le mieux à la production d’orge. L’orge supporte mieux les sols alcalins que les autres céréales, mais elle ne tolère pas les sols acides ; un pH de 6,0–8,5 est généralement acceptable. Elle est très sensible à l’asphyxie racinaire. Certains cultivars sont capables de faire face à une salinité du sol atteignant 1%.
Multiplication et plantation
L’orge se sème directement. Le poids de 1000 graines se situe à 25–50 g. Avant le semis, on laboure à une profondeur de 10–15 cm. Dans les petites exploitations, la préparation du sol s’effectue par traction animale. Il est préférable de traiter les semences avec un fongicide pour protéger la culture des maladies propagées par la graine et par le sol. L’orge peut se semer au semoir, mais sur les petites exploitations, le semis se fait d’habitude à la main. Avec le semoir, la distance entre les lignes est de 15–35 cm et la densité de semis est de 50–150 kg/ha. La profondeur de semis est de 2–6 cm.
Sur les hautes terres d’Ethiopie, l’orge est cultivée deux fois par an. La saison agricole principale (“meher”) se situe en juin–décembre (le gros des pluies tombant en juin–septembre), et la petite saison (“belg”) en février–juin (avec le gros des pluies en mars–avril). L’orge est la culture qui convient le mieux à la saison “belg”. On la trouve en général en culture pure, mais en Erythrée et au nord de l’Ethiopie, on l’associe souvent au blé (dans le système de culture nommé “hanfetz”). En Erythrée, la tradition est de semer à la volée des mélanges de 67% d’orge et de 33% de blé ; mais la proportion est parfois de 50:50. Tandis qu’en Ethiopie et en Erythrée, l’orge est cantonnée aux petites exploitations, au Kenya elle se cultive dans de grandes exploitations mécanisées.
Gestion
Les mauvaises herbes sont à l’origine de pertes économiques, du fait de la réduction du nombre de talles et de grains par épi. Les paysans sans ressources désherbent à la main. L’herbicide le plus couramment employé pour lutter contre les adventices dicotylédones en post-levée est le 2,4-D. L’orge nécessite environ 25–35 kg d’azote pour produire 1 t de grains. On peut épandre l’azote avant le semis ou en surface après le semis. Par temps sec, l’application de doses élevées d’azote peut entraîner des diminutions de rendement, tandis que sous conditions favorables, de fortes doses d’azote augmentent le risque de verse et de maladies. Un excès d’engrais azotés sur l’orge de brasserie peut augmenter le niveau de protéines du grain au-dessus du seuil acceptable.
En Ethiopie, les paysans ont coutume de faire pousser l’orge dans des sytèmes à faibles intrants, en limitant au minimum la préparation du lit de semis et le désherbage, et sans recourir aux herbicides, aux engrais ou aux insecticides. Une faible fertilité du sol et une mauvaise gestion des adventices représentent des contraintes importantes. Lors d’essais à Holetta, une application de 57 kg de N et de 25 kg de P par ha a entraîné une hausse de rendement en grains atteignant 200%, tandis qu’un seul désherbage manuel pratiqué 35 jours après la levée a produit un accroissement du rendement de 20% comparé à une culture non désherbée. La verse constitue également un problème fréquent dans la culture de l’orge en Ethiopie. En Afrique de l’Ouest, l’orge est une culture de saison sèche, souvent sous irrigation.
Maladies et ravageurs
L’orge est affectée par plusieurs maladies virales et fongiques. Les maladies virales les plus importantes sont le virus de la jaunisse nanisante de l’orge (BYDV), transmis par diverses espèces de pucerons, et le virus de la mosaïque striée de l’orge (BSMV), transmis par la graine ou par contact entre plantes. La lutte contre le BYDV fait appel à des cultivars tolérants ou résistants et à des mesures de lutte contre les pucerons ; pour le BSMV, on a recours à des semences exemptes de virus et à des cultivars résistants. Des épidémies de striure africaine des céréales causées par le virus de la striure du maïs (MSV) et transmises par des cicadelles (Cicadulina spp.) se sont déclarées au Kenya. Parmi les maladies fongiques importantes, il faut citer l’oïdium (Blumeria graminis f.sp. hordei, synonyme : Erysiphe graminis f.sp. hordei), les taches nécrotiques (Bipolaris sorokiniana, synonyme : Helminthosporium sativum), la rhynchosporiose (Rhynchosporium secalis f.sp. hordei), la tavelure (Fusarium spp.), les rouilles (Puccinia spp.), la rayure réticulée (Pyrenophora teres), l’helminthosporiose (Pyrenophora graminea) et les charbons (Ustilago spp.). En Ethiopie et en Erythrée, ce sont la rhynchosporiose, les helminthosporioses et les rouilles qui constituent les maladies fongiques les plus importantes ; le recours à des cultivars résistants est souvent la mesure de lutte la plus efficace. Les autres mesures comprennent la rotation des cultures, l’utilisation de semences saines ou traitées, les fongicides, la destruction du matériel végétal infecté et le labour profond. L’orge peut être parasitée par plusieurs nématodes : les nématodes à kyste des céréales (Heterodera spp.), les nématodes à galles (Meloidogyne spp.), les nématodes des tumeurs de racines (Subanguina radicicola) et les nématodes des lésions de racines (Pratylenchus spp.). Les mesures de lutte comprennent la rotation des cultures et la jachère. L’amélioration génétique pour la résistance et le recours aux pathogènes fongiques ont été employés avec succès contre les nématodes à kystes des céréales.
L’orge est sensible aux attaques de nombreux types de ravageurs, dont les pucerons, les mouches des pousses, les sauterelles, les grillons, les thrips, les légionnaires, les vers gris, ainsi que les coléoptères et leurs larves. On peut lutter contre ces ravageurs en jouant sur la date de semis et en appliquant des insecticides. En général, les pertes dues aux ravageurs sont relativement limitées, mais ils provoquent des dégâts bien plus importants comme vecteurs de virus, notamment le BYDV. Pour l’orge, les principaux ravageurs d’entreposage sont les insectes et les rongeurs.
Récolte
L’orge est prête à être récoltée lorsque le taux d’humidité du grain atteint 35–40%. La récolte se fait à la main à l’aide d’une faucille, ou à la moissonneuse-batteuse. Le battage de l’orge de brasserie et de l’orge nue nécessite un soin particulier pour éviter de briser trop de grains.
Rendement
Les rendements en orge varient de 0,3 t/ha les années sèches et dans des milieux marginaux à 10 t/ha en agriculture intensive. En Afrique, les rendements moyens se situent à 0,3–2,5 t/ha. En Asie et en Amérique du Sud, ces moyennes sont de 1,5–1,7 t/ha, en Amérique du Nord de 2,9 t/ha et en Europe de 4 t/ha. Les rendements en paille sont tout aussi importants dans de nombreux pays en voie de développement, mais on ne dispose pas de statistiques.
Traitement après récolte
Une teneur élevée en humidité dans les grains d’orge à la récolte favorise le développement de mycotoxines dangereuses pour l’homme et le bétail. Avant son stockage, le grain doit être séché pour atteindre au maximum 14% d’humidité. Lorsque l’orge est cultivée sur de petites superficies, il est courant de conserver certains épis choisis pour fournir la semence de la culture suivante.
Ressources génétiques
Les collections de ressources génétiques actuellement conservées à l’ICARDA (Centre international de recherche agricole sur les régions arides, à Alep, Syrie) contiennent plus de 25 000 entrées. L’ “International Barley Core Collection” a été constituée depuis 1989 par un consortium international auquel appartient l’ICARDA. De nombreux programmes nationaux maintiennent leurs propres collections de travail. L’Institute of Biodiversity Conservation (IBC, Addis Abéba, Ethiopie) possède une collection de plus de 12 500 entrées. En Afrique subsaharienne, de petites collections sont détenues en Afrique du Sud (National Department of Agriculture, Pretoria ; Small Grain Institute, Bethlehem), à Madagascar (Département de recherches agronomiques de la République malgache, à Antananarivo) et au Kenya (National Genebank of Kenya, KARI, à Kikuyu, Muguga). Au stockage, l’orge se comporte de façon orthodoxe.
Sélection
Les méthodes de sélection utilisées pour l’orge sont typiques des espèces autogames. Jusqu’en 1950, la principale méthode d’amélioration était soit la sélection massale soit la sélection de lignées pures au sein des variétés-populations, ces dernières étant toujours cultivées de nos jours dans de nombreux pays comme l’Ethiopie. Une nouvelle variabilité a été créée par croisement, croisement en retour et mutation. La sélection récurrente est employée pour augmenter la recombinaison, par croisement entre les plantes F1 et en répétant les croisements entre un certain nombre de F2, ou bien en ayant recours à des gènes de stérilité mâle. L’amélioration génétique par mutations, provoquées par radiations ou agents chimiques, et la technique des haploïdes doublés ont été largement utilisés chez l’orge. Parmi les centres internationaux, c’est l’ICARDA qui a reçu le mandat mondial d’assister les programmes d’amélioration de l’orge lancés par les systèmes nationaux de recherche agricole (SNRA) dans les pays en développement. La sélection moderne a donné naissance à des types dont la composition en acides aminés est améliorée (la lysine constituant 4,1% de la protéine). L’accent a été mis surtout sur la production de cultivars résistants aux maladies et ravageurs et adaptés à des environnements agroécologiques particuliers. Une résistance aux pucerons a été incorporée à certains cultivars. L’orge éthiopienne s’est avérée particulièrement utile dans l’amélioration de la qualité nutritionnelle et pour fournir des résistances aux maladies fongiques et virales (dont le mildiou, les charbons, les rouilles, l’helminthosporiose, la rhynchosporiose, le BYDV et le BSMV). En Ethiopie, 9 cultivars améliorés d’orge ont été mis sur le marché entre 1980 et 2000, mais leur taux d’adoption est faible (11% de la superficie).
Les premières cartes génétiques du génome de l’orge sont apparues en 1991, et à ce jour, il en a été publié plus de 40.
Perspectives
En général, d’importantes améliorations dans la production d’orge sont possibles grâce à la sélection de cultivars résistants à la verse et aux maladies. Etant donné que la plupart des efforts d’amélioration concernaient des milieux favorables, le potentiel de cette céréale en agriculture à faibles intrants est largement sous-exploité. Dans les hautes terres éthiopiennes, où l’orge est la culture vivrière favorite, la fertilité du sol a chuté en raison de l’érosion et d’une culture continue. Il a donc été difficile dans ces conditions d’améliorer les cultivars paysans adaptés localement. Le teff (Eragrostis tef (Zuccagni) Trotter), céréale de base éthiopienne, prend actuellement le pas sur l’orge en raison de prix favorables sur le marché, ce qui diminue l’importance des très productifs cultivars d’orge à 6 rangs. Dans ces régions, une sélection visant des cultivars à maturation précoce et à meilleure résistance / tolérance au stress hydrique que ceux qui existent à l’heure actuelle pourrait renverser la tendance. L’Ethiopie possède la capacité de faire face à la demande locale en orge de brasserie et à produire pour le marché africain. Elle peut y réussir en améliorant et en produisant une orge de brasserie de grande qualité, capable de répondre aux normes des brasseurs, en augmentant en parallèle le nombre et la capacité des malteries et en fournissant une infrastructure commerciale efficace.
Références principales
- Ceccarelli, S. & Grando, S., 1996. Hordeum vulgare L. In: Grubben, G.J.H. & Partohardjono, S. (Editors). Plant Resources of South-East Asia No 10. Cereals. Backhuys Publishers, Leiden, Netherlands. pp. 99–102.
- Gebre, H. & van Leur, J. (Editors), 1996. Barley research in Ethiopia: past work and future prospects. Proceedings of the first barley research review workshop, 16–19 October 1993, Addis Ababa, Ethiopia. Institute of Agricultural research, Addis Ababa, Ethiopia & International Center for Agricultural Research in the Dry Areas (ICARDA), Aleppo, Syria. 195 pp.
- Hanelt, P. & Institute of Plant Genetics and Crop Plant Research (Editors), 2001. Mansfeld’s encyclopedia of agricultural and horticultural crops (except ornamentals). 1st English edition. Springer Verlag, Berlin, Germany. 3645 pp.
- Harlan, J.R., 1995. Barley. In: Smartt, J. & Simmonds, N.W. (Editors). Evolution of crop plants. 2nd Edition. Longman, London, United Kingdom. pp. 140–147.
- Hockett, E.A., 2000. Barley. In: Kulp, K. & Ponte, J.G. (Editors). Handbook of cereal science and technology. 2nd Edition. Marcel Dekker, New York, United States. pp. 81–125.
- Mathre, D.E., 1997. Compendium of barley diseases. 2nd Edition. The American Phytopathological Society, St. Paul, Minnesota, United States. 90 pp.
- Nevo, E., 1992. Origin, evolution, population genetics and resources for breeding of wild barley, Hordeum spontaneum, in the fertile crescent. In: Shewry, P.R. (Editor). Barley: genetics, biochemistry, molecular biology and biotechnology. CAB International, Wallingford, United Kingdom. pp. 19–44.
- Rasmusson, D.C. (Editor), 1985. Barley. American Society of Agronomy, Madison, Wisconsin, United States. 522 pp.
- Slafer, G.A., Molina-Cano, J.L., Savin, R., Araus, J.L. & Romagosa, I., 2002. Barley science: recent advances from molecular biology to agronomy of yield and quality. Food Products Press, New York, United States. 565 pp.
- von Bothmer, R., Jacobsen, N. & Baden, C., 1995. An ecogeographical study of the genus Hordeum. 2nd Edition. Systematic and ecogeographic studies on crop genepools 7. IBPGR, Rome, Italy. 129 pp.
Autres références
- Asfaw, Z., 1990. An ethnobotanical study of barley in the central highlands of Ethiopia. Biologisches Zentralblatt 109(1): 51–62.
- Aw-Hassan, A. & Shideed, K., 2003. The impact of international and national investment in barley germplasm improvement in the developing countries. In: Evenson, R.E. & Gollin, D. (Editors). Crop variety improvement and its effect on productivity: the impact of international agricultural research. CABI Publishing, Wallingford, United Kingdom. pp. 241–256.
- Berhane, L., Yitbarek, S. & Fekadu, A., 1995. Evaluation of Ethiopian landraces for disease and agronomic characters. Rachis 14(1–2): 21–25.
- Briggs, D.E., 1978. Barley. Chapman & Hall, London, United Kingdom. 612 pp.
- Burkill, H.M., 1994. The useful plants of West Tropical Africa. 2nd Edition. Volume 2, Families E–I. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 636 pp.
- Clayton, W.D., 1972. Gramineae. In: Hepper, F.N. (Editor). Flora of West Tropical Africa. 2nd Edition. Volume 3, part 2. pp. 277–574.
- Engels, J.M.M., Hawkes, J.G. & Worede, M. (Editors), 1991. Plant genetic resources of Ethiopia. Cambridge University Press, Cambridge, United Kingdom. 383 pp.
- Launert, E., 1971. Gramineae (Bambuseae - Pappophoreae). In: Fernandes, A., Launert, E. & Wild, H. (Editors). Flora Zambesiaca. Volume 10, part 1. Flora Zambesiaca Managing Committee, London, United Kingdom. 152 pp.
- National Research Council, 1996. Lost crops of Africa. Volume 1: grains. National Academy Press, Washington D.C., United States. 383 pp.
- Phillips, S., 1995. Poaceae (Gramineae). In: Hedberg, I. & Edwards, S. (Editors). Flora of Ethiopia and Eritrea. Volume 7. Poaceae (Gramineae). The National Herbarium, Addis Ababa University, Addis Ababa, Ethiopia and Department of Systematic Botany, Uppsala University, Uppsala, Sweden. 420 pp.
- Purseglove, J.W., 1972. Tropical crops. Monocotyledons. Volume 1. Longman, London, United Kingdom. 334 pp.
- Rehm, S. & Espig, G., 1991. The cultivated plants of the tropics and subtropics: cultivation, economic value, utilization. CTA, Ede, Netherlands. 552 pp.
- Sharpley, J., 1988. The foreign exchange content of Kenyan agriculture. IDS (Institute of Development Studies) Bulletin 19(2): 16–27.
- Tarekegne, A., Gebre, H. & Francis, C.A., 1997. Yield limiting factors to food barley production in Ethiopia. Journal of Sustainable Agriculture 10(2–3): 97–113.
- Thomas, W.T.B., 2003. Prospects for molecular breeding of barley. Annals of Applied Biology 142(1): 1–12.
- USDA, 2004. USDA national nutrient database for standard reference, release 17. [Internet] U.S. Department of Agriculture, Agricultural Research Service, Nutrient Data Laboratory, Beltsville Md, United States. http://www.nal.usda.gov/fnic/foodcomp. November 2004.
- von Bothmer, R., van Hintum, T., Knüpffer, H. & Sato, K., 2003. Diversity in barley (Hordeum vulgare). Developments in plant genetics and breeding No 7. Elsevier, Amsterdam, Netherlands. 280 pp.
- Williams, K.J., 2003. The molecular genetics of disease resistance in barley. Australian Journal of Agricultural Research 54: 1065–1079.
- Woldeamlak, A., 2001. Mixed cropping of barley (Hordeum vulgare) and wheat (Triticum aestivum) landraces in the central highlands of Eritrea. PhD thesis, Wageningen University, Netherlands. 220 pp.
- Yirga, C., Alemayehu, F. & Sinebo, W. (Editors), 1998. Barley-based farming systems in the highlands of Ethiopia. Ethiopian Agricultural Research Organization, Addis Ababa, Ethiopia. 117 pp.
Sources de l'illustration
- Ceccarelli, S. & Grando, S., 1996. Hordeum vulgare L. In: Grubben, G.J.H. & Partohardjono, S. (Editors). Plant Resources of South-East Asia No 10. Cereals. Backhuys Publishers, Leiden, Netherlands. pp. 99–102.
Auteur(s)
- S. Ceccarelli, ICARDA, P.O. Box 5466, Aleppo, Syria
- S. Grando, ICARDA, P.O. Box 5466, Aleppo, Syria
Citation correcte de cet article
Ceccarelli, S. & Grando, S., 2006. Hordeum vulgare L. In: Brink, M. & Belay, G. (Editors). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Netherlands. Consulté le 18 décembre 2024.
- Voir cette page sur la base de données Prota4U.