Daniellia oliveri (PROTA)
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Légume | |
| Colorant / tanin | |
| Huile essentielle / exsudat | |
| Médicinal | |
| Bois d'œuvre | |
| Bois de feu | |
| Fourrage | |
| Auxiliaire | |
| Fibre | |
| Sécurité alimentaire | |
Daniellia oliveri (Rolfe) Hutch. & Dalziel
- Protologue: Bull. Misc. Inform. Kew 9: 382 (1928).
- Famille: Caesalpiniaceae (Leguminosae - Caesalpinioideae)
- Nombre de chromosomes: 2n = 22
Noms vernaculaires
- Arbre à vernis (Fr).
- West African copal tree, African copaiba balsam, Ilorin balsam, Accra copal, Benin gum copal (En).
- Pau-incenso (Po).
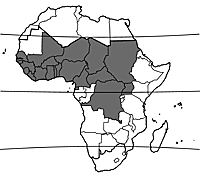
Origine et répartition géographique
On trouve Daniellia oliveri depuis le Sénégal jusqu’au Soudan et en Ouganda.
Usages
Le bois, vendu sous l’appellation “West African gum copal” et “daniellia”, est employé pour les parquets à usage modéré, les menuiseries, les boiseries intérieures, le mobilier, la construction nautique, les jouets et les articles de fantaisie, les abreuvoirs pour le bétail, les tambours, les bols, les mortiers à riz, les caisses d’emballage, les égouttoirs, la sculpture, les placages, le contreplaqué, les panneaux de fibres et de particules. Cependant, la gomme le rend trop gommeux pour les menuiseries et les objets sculptés de qualité supérieure. Il est très apprécié comme bois de feu, car il dégage une odeur parfumée en se consumant lentement. On en fait aussi du charbon de bois. On l’utilise pour la fabrication du papier. La cendre est parfois employée pour la production de savon.
On fait des ruches avec de grandes bandes d’écorce. La résine ou la gomme, vendue sous le nom de “gomme copal” et de “baume de copaïba africain”, est parfumée, et est utilisée en torche ou comme encens lors des cérémonies religieuses et pour désinfecter par fumigation les maisons et les vêtements pour en chasser les insectes. En outre, la gomme sert à fixer les fers des lances. La gomme réduite en poudre est appliquée sur les tissus pour les faire briller, et sur les meubles comme encaustique ou vernis, pour les lustrer et les rendre plus résistants aux termites. Elle ne convient pas comme encaustique commerciale pour meubles car elle n’est soluble ni dans la térébenthine ni dans l’alcool. Néanmoins, elle peut être estérifiée pour produire une laque. Au Nigeria, on fait tremper les tambours dans une solution à base de gomme pour en renforcer la teinte.
La gomme et l’écorce de la tige, et dans une moindre mesure, les racines et les feuilles, sont très utilisées en médecine traditionnelle. On fait brûler la gomme, l’écorce et les feuilles et on en inhale la fumée pour soigner le mal de tête et la migraine ; la fumée sert également à éloigner les moustiques. On mâche puis on avale la gomme comme purgatif pour traiter la diarrhée. En Côte d’Ivoire, la gomme est considérée comme aphrodisiaque et diurétique, et on la mâche en cas de toux, de maux de tête, de tachycardie et de règles douloureuses. En usage externe, elle soigne les démangeaisons et les affections cutanées. La gomme et l’écorce entrent dans la fabrication de plusieurs préparations, en usage interne et externe, parfois avec d’autres parties de la plante, pour soigner les maladies vénériennes, les ulcères et les lésions, les blessures de la circoncision, la lèpre, la dysenterie, la colique, les troubles menstruels, la toux, le rhume, l’angine, la bronchite, la tuberculose, les affections rénales, l’appendicite, le mal de tête, le mal de dos, les rhumatismes, les douleurs dues à la fièvre, la hernie, les douleurs dentaires et les morsures de serpent. La racine est considérée comme diurétique et la décoction se prend pour traiter les maladies vénériennes, l’aménorrhée, l’anxiété, la démence, l’empoisonnement alimentaire et les affections cutanées. On ajoute les ramilles feuillées à l’eau du bain et on prend un bain de vapeur en cas de fièvre et de jaunisse, et comme tonique. La décoction de ramilles feuillés additionnée de sel est prescrite comme purgatif, contre la constipation et les douleurs d’estomac. L’infusion de bourgeons foliaires se prend en cas de migraine et de fébrilité chez les enfants qui ont des poussées dentaires. On applique les jeunes feuilles pilées sur les plaies, les brûlures et les abcès pour les faire mûrir, ainsi que sur les parties douloureuses du corps. On se gargarise avec la décoction de feuilles pour soigner les douleurs dentaires et on la boit en cas de colique. Les stipules, de grande taille, servent à recouvrir les plaies, les ulcères et les blessures, et de tampons pour les femmes pendant leurs règles. Au Burkina Faso, la décoction d’écorce de la tige est administrée aux moutons et aux chèvres pour soigner leurs vers intestinaux. Au Nigeria, on applique la gomme sur la peau des chevaux pour les traiter contre la gale.
Les jeunes feuilles sont consommées avec des condiments ou bien cuites dans des soupes en période de famine. Il arrive aussi que l’on mange les graines comme les fruits. Le bétail n’hésite pas à brouter les feuilles qui servent aussi de fourrage. Les racines font d’excellents bâtonnets à mâcher. On mâche parfois la gomme car elle est sucrée, ou on s’en sert comme produit d’obturation en dentisterie. On en fait aussi de fausses perles d’ambre. On ajoute l’écorce lors du brassage de la bière pour en accélérer la fermentation. On rajoute des branches grillées au vin de palme pour le rendre plus digeste. L’écorce brûlée sert à noircir l’intérieur des pots. L’arbre est utilisé dans les programmes de reboisement, il est planté en brise-vent et comme arbre d’alignement. Les feuilles servent au paillage. Les fleurs sont nectarifères et sont visitées par les abeilles. Au Ghana, Daniellia oliveri a la réputation d’être un indicateur de la présence de nappe phréatique. Les enfants portent un morceau de gomme autour du cou comme porte-bonheur pour éloigner le mauvais œil.
Production et commerce international
Daniellia oliveri ne joue pas un rôle important sur le marché international des bois d’œuvre, mais il est couramment employé localement sur l’ensemble de son aire de répartition, comme d’autres Daniellia spp.
Propriétés
Le bois de cœur, rouge-brun, gris ou rouge à stries foncées, se distingue assez nettement de l’aubier blanchâtre, teinté de rose ou de brun et de 8 cm de large. Il présente un contrefil ; le grain est moyen à grossier. Le bois est lustré et contient une oléorésine jaune ou brune.
C’est un bois léger à moyennement lourd, avec une densité de 510–680 kg/m³ à 12% d’humidité, modérément tendre en dépit de sa résistance et de sa solidité. Les taux de retrait sont modérés, de l’état vert à anhydre ils sont de 2,8–3,5(–5,6)% dans le sens radial et de 3,7–7,0(–9,3)% dans le sens tangentiel. Le séchage à l’air est assez rapide et ne provoque que peu d’altérations. Une fois sec, le bois est modérément stable en service. A 12% d’humidité, le module de rupture est de 56–114 N/mm², le module d’élasticité de 6280–9700 N/mm², la compression axiale de 25–63 N/mm², le cisaillement de 5–15 N/mm², le fendage de 12–28 N/mm et la dureté de flanc Chalais-Meudon de 1,2–3,4(–5,8).
Le bois se scie et se travaille facilement tant à la main qu’à la machine, et n’émousse que faiblement les dents de scies et les lames de coupe. Il se colore de manière satisfaisante mais nécessite un enduit avant le polissage. En général, il se cloue et se visse bien et se colle comme il faut. On peut facilement obtenir des placages déroulés, mais ils peuvent gauchir au séchage. Ce n’est pas un bois durable, car il peut être attaqué par les champignons, les termites, les scolytes, les Lyctus et les térébrants marins. Le bois de cœur est rebelle à l’imprégnation avec des produits de conservation et l’aubier présente une perméabilité variable.
Le bois contient 40,5–42% de cellulose, 27,5–28% de lignine, 18–19% de pentosanes et 0,8–1,0% de cendres. La solubilité est de 3,6–7,3% dans l’alcool-benzène, de 2,3–4,2% dans l’eau chaude et de 19,4–20,2% dans une solution de NaOH à 1%.
La gomme qui est sécrétée par le bois de cœur est jaune à brun foncé, grasse et gluante. Elle est riche en huiles essentielles (30–35%), et l’un des principaux composés est l’acide daniellique (acide illurinique), une oléorésine diterpénique, ainsi que l’acide ozique et l’ozol, un alcool. Les huiles essentielles présentes dans les feuilles contiennent essentiellement des sesquiterpénoïdes, principalement le δ-cadinène (24,2–31,1%) et l’α-copaène (7,0–8,3%). Des hétérosides flavonoïdes, la rutine, la quercitrine et la querciméritrine, ont été isolés des feuilles. Les feuilles séchées contiennent environ 5,5% de protéines. L’huile essentielle de l’écorce produit uniquement des sesquiterpénoïdes, principalement l’α-copaène (6,0–12,0%), le germacrène D (4,5–79,5%) et le δ-cadinène (25,5–29,8%). Des tanins, des saponines, et des hétérosides cyanogénétiques et cardiaques ont également été isolés de l’écorce. La teneur en protéines des graines est très élevée (33,4%), celle en glucides l’est modérément (44,6%). Parmi les minéraux présents dans les graines, le plus abondant est Ca (263 mg/100 g), les moins abondants sont Zn, Cu et Mn. Il s’est avéré également que plusieurs composés, parmi lesquels le cyanure, les polyphénols, le phytate et l’oxalate, considérés comme anti-nutritionnels, étaient présents en petites quantités.
Des extraits à l’hexane et au méthanol de l’écorce ont été soumis à des essais en vue de détecter leur action analgésique, antipyrétique et anti-inflammatoire. Des extraits à l’hexane ont mis en lumière une activité analgésique liée à la dose chez la souris, et des extraits au méthanol ont démontré des propriétés inflammatoires chez le rat. Des études de cages métaboliques ont montré que l’extrait à l’éthanol faisait baisser nettement le poids corporel, la consommation d’aliments et la production d’urine et de matières fécales du rat. L’extrait a également fait ressortir un antagonisme compétitif sur la contraction induite par l’histamine de l’iléon de cobaye et une inhibition non-compétitive de la contraction induite par l’acétylcholine du muscle droit de l’abdomen de la grenouille. Un extrait aqueux de l’écorce a montré de nettes activités antinociceptives dose-dépendantes, après injection par voie intrapéritonéale chez le rat et la souris. L’extrait a révélé une activité anti-inflammatoire non dose-dépendante. L’effet a été significatif à des doses de 100 et 200 mg/kg. On a constaté que la DL50 de la décoction d’écorce chez le mouton était de 3500 mg/kg. Les hétérosides cardiaques présents dans l’extrait au méthanol de l’écorce se sont révélés des antagonistes non-compétitifs des récepteurs muscariniques. On a constaté que les extraits méthanoliques des feuilles et de l’écorce possèdent des propriétés de blocage neuromusculaire chez le rat.
Différents extraits à l’eau et à l’éthanol des feuilles, de l’écorce et des racines ont mis en lumière une action antibactérienne in vitro modérée à importante contre une série de bactéries pathogènes. L’extrait à l’éthanol des feuilles a également fait apparaître une nette activité antifongique contre Tricophyton rubrum. Un extrait cru de l’écorce s’est avéré avoir une importante activité anthelminthique dose-dépendante sur le parasite gastro-intestinal Haemonchus contortus in vitro. Un essai mené en pots a montré qu’un paillis à base de feuilles de Daniellia oliveri avait un effet inhibiteur sur la germination du soja, du niébé, du maïs, du sorgho et du millet.
Falsifications et succédanés
Le bois d’autres Daniellia spp. originaires d’Afrique de l’Ouest sert aux mêmes usages que celui de Daniellia oliveri.
Description
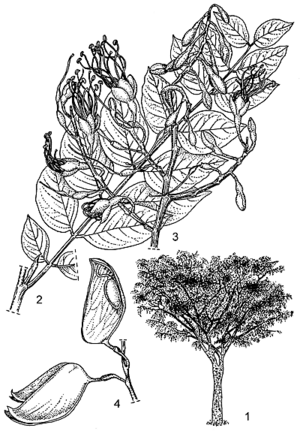
- Arbre de taille moyenne atteignant 25(–35) m de haut, caducifolié ; fût droit et cylindrique, jusqu’à 200 cm de diamètre, dépourvu de contreforts ; surface de l’écorce lisse, blanc grisâtre, devenant écailleuse chez les sujets âgés, se desquamant en grandes plaques circulaires, écorce interne épaisse, rouge sombre ; cime dense, en forme de cône inversé ; rameaux glabres.
- Feuilles alternes, composées paripennées à (3–)6–11 paires de folioles ; stipules jusqu’à 6,5(–9) cm × 0,5 cm, précocement caduques ; pétiole de (2–)2,5–3,5(–5,5) cm de long, rachis de (17–)24–33(–52) cm de long, superficiellement rainuré, devenant quadrangulaire vers l’apex, à pubescence courte et éparse, pourvu de glandes au point d’insertion des folioles ; pétiolules de 3–15 mm de long ; folioles opposées, oblongues-ovales à lancéolées, atteignant 15(–21) cm × 7 (–10) cm, les folioles basales et apicales plus petites que les moyennes, cunéiformes à la base, asymétriques, acuminées à l’apex, papyracées à coriaces, à bords légèrement ondulés, à poils courts clairsemés à denses ou presque glabres, à points glandulaires translucides peu nombreux, pennatinervées à 9–17 paires de nervures latérales.
- Inflorescence : grappe composée, axillaire ou terminale de 15–20(–25) cm de long, glabre à densément poilue, à 6–16 branches latérales.
- Fleurs bisexuées, zygomorphes, odorantes ; pédicelle de 7–13 mm de long, glabre, s’allongeant dans le fruit, pourvu au-dessous du milieu de 2 bractéoles caduques d’environ 0,5 cm de long ; sépales 4, oblongs, d’environ 1,5 cm de long, glabres mais à bords pubescents ; pétales 5, blancs à crème, inégaux, ovales-elliptiques, 4 pétales de 1–1,5(–3) mm de long et un d’environ 1 cm de long, presque glabres, ponctués de quelques points glandulaires ; étamines 10, libres, de (2–)3–4 cm de long ; ovaire supère, oblong-lancéolé, de 0,5–1 cm de long, glabre, à stipe d’environ 0,5 cm de long, style atteignant 3 cm de long.
- Fruit : gousse obliquement lancéolée, aplatie, de 6–10 cm × 3–4,5 cm, munie d’un stipe d’environ 1 cm de long, glabre, verte devenant brune, déhiscente par 2 valves papyracées, contenant une seule graine.
- Graines obovoïdes-ellipsoïdes, aplaties, de 2–2,5 cm de long, lisses, brun foncé, attachées à l’une des valves par un funicule de 1–2 cm de long.
- Plantule à germination épigée.
Autres données botaniques
Le genre Daniellia comprend une dizaine d’espèces qui sont presque toutes confinées aux zones forestières d’Afrique de l’Ouest et centrale ; seule Daniellia oliveri s’étend jusqu’au Soudan et en Ouganda.
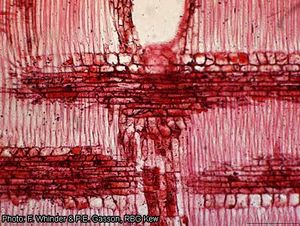
Anatomie
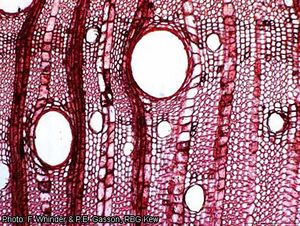
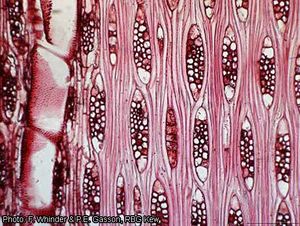
Description anatomique du bois (codes IAWA pour les bois feuillus) :
- Cernes de croissance : 2 : limites de cernes indistinctes ou absentes.
- Vaisseaux : 5 : bois à pores disséminés ; 13 : perforations simples ; 22 : ponctuations intervasculaires en quinconce ; 23 : ponctuations alternes (en quinconce) de forme polygonale ; 26 : ponctuations intervasculaires moyennes (7–10 μm) ; 27 : ponctuations intervasculaires grandes (≥ 10 μm) ; 29 : ponctuations ornées ; 30 : ponctuations radiovasculaires avec des aréoles distinctes ; semblables aux ponctuations intervasculaires en forme et en taille dans toute la cellule du rayon ; 42 : diamètre tangentiel moyen du lumen des vaisseaux 100–200 μm ; 43 : diamètre tangentiel moyen du lumen des vaisseaux ≥ 200 μm ; 46 : ≤ 5 vaisseaux par millimètre carré ; 47 : 5–20 vaisseaux par millimètre carré ; 58 : gomme ou autres dépôts dans les vaisseaux du bois de cœur.
- Trachéides et fibres : 61 : fibres avec des ponctuations simples ou finement (étroitement) aréolées ; 66 : présence de fibres non cloisonnées ; 69 : fibres à parois fines à épaisses. Parenchyme axial : (79 : parenchyme axial circumvasculaire (en manchon)) ; 80 : parenchyme axial circumvasculaire étiré ; 81 : parenchyme axial en losange ; 83 : parenchyme axial anastomosé ; 89 : parenchyme axial en bandes marginales ou semblant marginales ; 91 : deux cellules par file verticale ; 92 : quatre (3–4) cellules par file verticale.
- Rayons : 97 : rayons 1–3-sériés (larges de 1–3 cellules) ; 98 : rayons couramment 4–10-sériés ; 106 : rayons composés de cellules couchées avec une rangée terminale de cellules dressées et/ou carrées ; (107 : rayons composés de cellules couchées avec 2 à 4 rangées terminales de cellules dressées et/ou carrées) ; 115 : 4–12 rayons par mm.
- Structure étagée : 118 : tous les rayons étagés ; 120 : parenchyme axial et/ou éléments de vaisseaux étagés ; (121 : fibres étagées).
- Eléments sécrétoires et variantes cambiales : 127 : canaux axiaux en longues lignes tangentielles ; 128 : canaux axiaux en courtes lignes tangentielles.
Croissance et développement
Daniellia oliveri passe pour un arbre à croissance relativement rapide. Au Mali, des semis ont atteint 18 cm de haut 10–15 semaines après le semis, et en Côte d’Ivoire et au Burkina Faso 45 cm et 32 cm, respectivement, 32 mois après la plantation. En Côte d’Ivoire, la hauteur moyenne de gaules âgés de 4,5 ans a été de 90 cm et de 130 cm à 5,5 ans, avec un taux de survie de 57%. Au Mali, des drageons ont atteint 2,4 m de haut au bout de 5,5 ans. En Côte d’Ivoire et au Bénin, la croissance moyenne en diamètre de fût est de 6 mm/an, même si au Burkina Faso on a observé des cernes de croissance atteignant 20 mm de large. Daniellia oliveri fleurit pendant la première moitié de la saison sèche, d’octobre à mars, normalement lorsque les arbres sont défeuillés ou forment de nouvelles feuilles, et fructifie du mois de janvier au mois de juin.
Ecologie
Daniellia oliveri est présent dans la savane arborée, la savane arbustive et la savane herbeuse plus claire, sur tout type de sol, mais souvent sur des sols sablonneux, depuis le niveau de la mer jusqu’à 1500 m d’altitude. C’est souvent l’un des arbres dominants de la savane humide et il peut lui arriver de former par endroits des peuplements presque purs, comme dans les zones temporairement inondées de la zone sahélienne. On le trouve parfois sur les termitières. Il résiste aux incendies pour autant qu’ils ne soient pas trop fréquents et qu’ils n’éclatent pas trop tard pendant la saison sèche.
Multiplication et plantation
Daniellia oliveri est une espèce exigeante en lumière. La régénération naturelle se fait souvent correctement. On compte environ 600 graines par kg. Etant donné qu’elles peuvent être attaquées par les insectes, il faut leur ajouter de la cendre pendant le stockage pour éviter qu’elles ne s’abîment. Il faut les tremper dans l’eau pendant 72 heures avant de les semer. Le taux de germination est de l’ordre de 75–95% en l’espace de 2–3 semaines. La croissance en pépinière est lente et irrégulière. Le repiquage des semis ne donne pas de bons résultats ; des racines pivotantes se formant rapidement, il faut ébarber les racines fréquemment pour que la plantation soit réussie. En Côte d’Ivoire et au Burkina Faso, le meilleur taux de survie 3 ans après la plantation a été de 60%, mais la plupart du temps il a été inférieur à 20%. Les graines peuvent aussi être semées directement au champ. Daniellia oliveri peut également se multiplier par drageons.
Gestion
Après le repiquage, il est nécessaire de pratiquer des dégagements à cause de la lenteur de la croissance des semis. Daniellia oliveri produisant de nombreux drageons, il n’est pas rare de trouver un grand nombre de petits arbres regroupés au même endroit. Il peut être conduit en taillis. Au Ghana, il est planté à titre expérimental dans le but de fournir du fourrage au bétail. Il peut être taillé régulièrement pour la production de fourrage.
Maladies et ravageurs
Daniellia oliveri est un hôte facultatif de la maladie des taches foliaires du karité (Vitellaria paradoxa C.F.Gaertn.), provoquée par Pestalotia spp. Eléphants et babouins se nourrissent fréquemment des feuilles.
Récolte
On extrait la résine ou la gomme en écorçant partiellement le fût ou en pratiquant une incision jusqu’au cœur, ce qui a pour effet de faire couler la résine. On peut accélérer le processus en mettant le feu dans le trou, mais cette pratique peut être fatale aux petits arbres.
Rendement
Dans la savane boisée naturelle de Côte d’Ivoire, des arbres ayant un diamètre de fût moyen de 80 cm produisent en moyenne 2,25 m³ de grumes et 3,4 m³ de bois de feu. Le rendement en bois de feu et la rentabilité d’un taillis traditionnel de Daniellia oliveri à révolution courte sur des jachères du nord du Bénin se sont nettement améliorés une fois que trois désherbages ont été effectués sur une période de 42 mois, alors que la biomasse totale a atteint en moyenne 3,67 t/ha de matière sèche sur des parcelles envahies de mauvaises herbes et 11,63 t/ha sur des parcelles désherbées. La plus grande partie de la biomasse a pu être commercialisée sur les marchés locaux.
Traitement après récolte
Les grumes doivent être converties rapidement après l’abattage ou bien traitées avec des produits de conservation afin d’éviter les attaques de champignons et d’insectes.
Ressources génétiques
L’aire de répartition de Daniellia oliveri est étendue mais irrégulière, et l’espèce est commune par endroits, souvent grégaire. Dès lors, elle n’est pas considérée comme menacée par l’érosion génétique, en dépit de l’absence d’information concernant son exploitation actuelle comme essence à bois d’œuvre, comme bois de feu et comme plante médicinale.
Perspectives
Daniellia oliveri est une importante essence à bois d’œuvre de la zone forestière sèche d’Afrique de l’Ouest, car sa croissance est rapide, elle est d’assez grande taille et son bois se travaille facilement. Elle a pour elle toute une palette d’autres usages, notamment sa gomme et son écorce qui sont très employées en médecine. Il faut cependant approfondir les recherches dans le domaine de la pharmacologie de la gomme et de l’écorce afin d’évaluer les possibilités qu’elles recèlent. Pour l’instant, leurs activités antibactériennes et anthelminthiques semblent plutôt prometteuses. Par ailleurs, il est impératif de disposer d’informations supplémentaires sur les débouchés qu’elle offrirait en tant que plante fourragère.
Références principales
- Arbonnier, M., 2004. Trees, shrubs and lianas of West African dry zones. CIRAD, Margraf Publishers Gmbh, MNHN, Paris, France. 573 pp.
- Avohou, T.H., Houehounha, R., Glele-Kakai, R., Assogbadjo, A.E. & Sinsin, B., 2011. Firewood yield and profitability of a traditional Daniellia oliveri short-rotation coppice on fallow lands in Benin. Biomass and Bioenergy 35(1): 562–571.
- Baerts, M. & Lehmann, J., 2012. Daniellia oliveri. [Internet] Prelude Medicinal Plants Database. Metafro-Infosys, Royal Museum for Central Africa, Tervuren, Belgium http://www.metafro.be/prelude. January 2012.
- Bolza, E. & Keating, W.G., 1972. African timbers: the properties, uses and characteristics of 700 species. Division of Building Research, CSIRO, Melbourne, Australia. 710 pp.
- Burkill, H.M., 1995. The useful plants of West Tropical Africa. 2nd Edition. Volume 3, Families J–L. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 857 pp.
- de la Estrella, M., Aedo, C., Mackinder, B. & Velayos, M., 2010. Taxonomic revision of Daniellia (Leguminosae: Caesalpinioideae). Systematic Botany 35(2): 296–324.
- Katende, A.B., Birnie, A. & Tengnäs, B., 1995. Useful trees and shrubs for Uganda: identification, propagation and management for agricultural and pastoral communities. Technical Handbook 10. Regional Soil Conservation Unit, Nairobi, Kenya. 710 pp.
- Neuwinger, H.D., 2000. African traditional medicine: a dictionary of plant use and applications. Medpharm Scientific, Stuttgart, Germany. 589 pp.
- Oteng-Amoako, A.A. (Editor), 2006. 100 tropical African timber trees from Ghana: tree description and wood identification with notes on distribution, ecology, silviculture, ethnobotany and wood uses. 304 pp.
- Takahashi, A., 1978. Compilation of data on the mechanical properties of foreign woods (part 3) Africa. Shimane University, Matsue, Japan. 248 pp.
Autres références
- Adama, K., Gaston, B.A.M., Hamidou H.T., Amadou, T. & Laya, S., 2009. In vitro anthelmintic effect of two medicinal plants (Anogeissus leiocarpus and Daniellia oliveri) on Haemonchus contortus, an abosomal nematode of sheep in Burkina Faso. African Journal of Biotechnology 8(18): 4690–4695.
- Adubiaro, H.O., Olaofe, O. & Akintayo, E.T., 2011. Chemical composition, calcium, zinc and phytate interrelationships in Albizia lebbeck and Daniellia oliveri seeds. Electronic Journal of Environmental, Agricultural and Food Chemistry 10(7): 2523–2530.
- Ahmadu, A., Kaita, H.A., Garba, M. & Yaro, A.H., 2003. Antispasmodic actions of the leaves of Daniellia oliveri. Nigerian Journal of Natural Product and Medicine 7: 13–15.
- Ahmadu, A, Haruna, A.K., Garba, M., Ehinmidu, J.O. & Sarker, S.D., 2004. Phytochemical and antimicrobial activities of the Daniellia oliveri leaves. Fitoterapia 75(7–8): 729–732.
- Balogun, E.A. & Adebayo, J.O., 2007. Effect of ethanolic extract of Daniella oliveri leaves on some cardiovascular indices in rats. Pharmacognosy Magazine 3(9): 16–20.
- Bellefontaine, R., Edelin, C., Ichaou, A., du Laurens, D., Monsarrat, A. & Loquai, C., 2000. Le drageonnage, alternative aux semis et aux plantations de ligneux dans les zones semi-arides: protocole de recherches. Sécheresse 11(4): 221–226.
- CTFT (Centre Technique Forestier Tropical), 1955. Fiche botanique, forestière, industrielle et commerciale: Faro (Daniellia spp.). Bois et Forêts des Tropiques 44: 17–20.
- El Mahmood, A.M., Doughari, J.H. & Chanji, F.J., 2008. In vitro antibacterial activities of crude extracts of Nauclea latifolia and Daniella oliveri. Scientific Research and Essays 3(3): 102–105.
- Hayashi, Y. & Carsky, R.J., 1997. Effect of use of savanna tree leaves as mulch materials on germination and growth of selected annual crop seedlings. Japanese Journal of Tropical Agriculture 41(1): 14–21.
- Kaboré, A., Tamboura, H.H., Traoré, A., Traoré, A., Meda, R., Kiendrebeogo, M., Gaston, B.A.M. & Sawadogo, L., 2010. Phytochemical analysis and acute toxicity of two medicinal plants (Anogeissus leiocarpus and Daniellia oliveri) used in traditional veterinary medicine in Burkina Faso. Archives of Applied Science Research 2(6): 47–52.
- Louppe, D. & Ouattara, N., 1996. Station Kamonon Diabaté (Korhogo), résultants des mensurations de 1996. Institut des Forêts, Korhogo, Côte d’Ivoire. 54 pp.
- Louppe, D., M’Bla, K. & Coulibaly, A., 1994. Tarifs de cubage pour Daniellia oliveri en forêt de Badénon (Nord Côte d’Ivoire). IDEFOR-DFO, Abidjan, Côte d’Ivoire. 16 pp. + annexes.
- Menut, C., Lamaty, G., Bessière, J.M., Ayedoun, M.A., Setondji, J., Samate, D. & Nacro, M., 1994. Aromatic plants from tropical West Africa. II. Volatile constituents of Daniellia oliveri (Rolfe) Hutch and Dalz. from Benin and Burkina Faso. Journal of Essential Oil Research 6(6): 647–649.
- Onwukaeme, N.D., 1995. Pharmacological activities of extracts of Daniellia oliveri (Rolfe) Hutch. and Dalz. (Leguminosae). Phytotherapy Research 9(4): 306–308.
- Onwukaeme, N.D., Lot, T.Y. & Udoh, F.V., 1999. Effects of Daniellia oliveri stem bark and leaf extracts on rat skeletal muscle. Phytotherapy Research 13(5): 419–421.
- Osakwe, I.I., Steingass, H. & Drochaner, W., 2004. Daniellia oliveri as a fodder tree for small ruminant and the interaction of its tannin with ruminal ammonia. Nigerian Journal of Animal Production 31(1): 56–64.
- Schwob, I., Viano, J., Bessiere, J.M. & Haddad, C., 2008. Comparison of essential oil composition of Daniellia oliveri (Rolfe) Hutch et Dalz. (Caesalpiniaceae) leaves from Senegal and Ivory Coast. Journal of Essential Oil Research 20(2): 155–157.
- SEPASAL, 2012. Daniellia oliveri. [Internet] Survey of Economic Plants for Arid and Semi-Arid Lands (SEPASAL) database. Royal Botanic Gardens, Kew, Richmond, United Kingdom. http://www.kew.org/ ceb/sepasal/. February 2012.
- Taïta, P., 2000. La biodiversité des espèces spontanées utilisées dans l’alimentation et la pharmacopée dans la région de la réserve de biosphère de la Mare aux Hippopotames. In: Actes du Forum National de la Recherche Scientifique et des Innovations Technologiques (FRSIT), 3–8 avril 2000, Ouagadougou, Burkina Faso. Tome 2. Sécurité alimentaire. pp. 77–95.
- Wilczek, R., Léonard, J., Hauman, L., Hoyle, A.C., Steyaert, R., Gilbert, G. & Boutique, R., 1952. Caesalpiniaceae. In: Robyns, W., Staner, P., Demaret, F., Germain, R., Gilbert, G., Hauman, L., Homès, M., Jurion, F., Lebrun, J., Vanden Abeele, M. & Boutique, R. (Editors). Flore du Congo belge et du Ruanda-Urundi. Spermatophytes. Volume 3. Institut National pour l’Étude Agronomique du Congo belge, Brussels, Belgium. pp. 234–554.
Sources de l'illustration
- Brenan, J.P.M., 1967. Leguminosae, subfamily Caesalpinioideae. In: Milne-Redhead, E. & Polhill, R.M. (Editors). Flora of Tropical East Africa. Crown Agents for Oversea Governments and Administrations, London, United Kingdom. 230 pp.
- Eggeling, W.J. & Dale, I.R., 1951. The indigenous trees of the Uganda Protectorate. Government Printer, Entebbe, Uganda. 491 pp.
Auteur(s)
- G.H. Schmelzer, PROTA Network Office Europe, Wageningen University, P.O. Box 341, 6700 AH Wageningen, Netherlands
- D. Louppe, CIRAD, Département Environnements et Sociétés, Cirad es-dir, Campus international de Baillarguet, TA C 105 / D (Bât. C, Bur. 113), 34398 Montpellier Cédex 5, France
Citation correcte de cet article
Schmelzer, G.H. & Louppe, D., 2012. Daniellia oliveri (Rolfe) Hutch. & Dalziel. [Internet] Fiche de PROTA4U. Lemmens, R.H.M.J., Louppe, D. & Oteng-Amoako, A.A. (Editeurs). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Pays Bas.
Consulté le 18 décembre 2024.
- Voir cette page sur la base de données Prota4U.