Breonadia salicina (PROTA)
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Oléagineux | |
| Glucides / amidon | |
| Médicinal | |
| Bois d'œuvre | |
| Bois de feu | |
| Ornemental | |
| Auxiliaire | |
| Fibre | |
Breonadia salicina (Vahl) Hepper & J.R.I.Wood
- Protologue: Kew Bull. 36(4) : 860 (1982).
- Famille: Rubiaceae
Synonymes
- Adina microcephala (Delile) Hiern (1877)
- Breonadia microcephala (Delile) Ridsdale (1975)
Noms vernaculaires
- Water shea nut, African teak, wild oleander (En).
- Mgwina (Sw).
Origine et répartition géographique
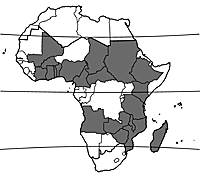
Breonadia salicina est largement réparti en Afrique tropicale, de la Côte d’Ivoire et du Mali jusqu’en Ethiopie, et vers le sud jusqu’en Angola, au Zimbabwe, au Mozambique et à Madagascar. On le trouve également en Afrique du Sud, au Swaziland et au Yémen. Il est parfois planté.
Usages
Le bois convient pour la construction lourde (y compris les ponts), les parquets à usage élevé, la menuiserie, les étais de mines, la construction nautique, la charronnerie, le mobilier, les articles de sport, les jouets et les articles de fantaisie, les instruments agricoles, les traverses de chemin de fer, les pilots de marine, la sculpture, le modelage et le tournage. On en fait des arcs au Nigeria, des coffres à Madagascar, tandis qu’au Malawi et à Madagascar, on confectionne des pirogues monoxyles avec les fûts. Dans le sud de la Tanzanie, le bois sert fréquemment de bois de feu.
On utilise les rameaux pour se brosser les dents en Afrique de l’Ouest. Breonadia salicina est souvent planté comme arbre ornemental, parfois aussi pour lutter contre l’érosion et comme brise-vent. C’est une espèce mellifère. A Madagascar, on rajoute l’écorce à des boissons alcoolisées locales (“toaka gasy”) pour les faire fermenter.
Breonadia salicina est fréquemment utilisé en médecine traditionnelle africaine. La décoction de racine se boit comme purgatif en Tanzanie et contre la tachycardie en Afrique du Sud. L’infusion de tige broyée est prescrite aux nourrissons en Ethiopie dans le traitement de la diarrhée et des vomissements. En Tanzanie, l’infusion d’écorce sert à prévenir la grippe et à traiter les problèmes d’estomac, la décoction ou l’infusion d’écorce servant de lotion antiseptique sur les plaies. Réduite en poudre et séchée, l’écorce est appliquée comme pansement. Au Malawi, on mâche l’écorce en cas de diarrhée et de maux d’estomac, et l’infusion d’écorce se boit contre la pneumonie. A Madagascar, on utilise la décoction d’écorce interne en bain de bouche en cas de caries et d’abcès. La décoction de feuille s’emploie au Nigeria dans l’eau du bain pour soigner la fièvre jaune. Au Malawi, l’infusion de feuille se boit en cas de diarrhée et de maux d’estomac. A Madagascar, on boit la décoction de feuille comme antipaludéen. En Ethiopie, on jette les graines dans le feu et on expose le patient à la fumée contre les douleurs articulaires. En médecine vétérinaire au Nigeria, l’écorce s’utilise en cas de diarrhée. Au Nigeria, tant les racines que l’écorce entrent dans la composition de poisons de flèche à base de Strophanthus sarmentosus DC.
Propriétés
La couleur du bois de cœur peut varier, allant du jaunâtre au brun pâle, au brun rosé, brun foncé, gris foncé ou rougeâtre, avec des taches brunes ou noires ; il se distingue nettement ou pas de l’aubier qui mesure 2,5–5 cm de large. Le fil est droit ou ondulé, le grain est fin et régulier. A la coupe, le bois est huileux au toucher et dégage une odeur caractéristique qui n’est pas sans rappeler l’huile de lin.
C’est un bois lourd, avec une densité de 830–960 kg/m³ à 12% d’humidité, solide et dur. Il sèche à l’air correctement si on le fait sécher lentement, même s’il arrive que des gerces superficielles apparaissent. Les taux de retrait sont modérés, de l’état vert à anhydre ils sont de 3,3–4,0% dans le sens radial et de 6,0–6,7% dans le sens tangentiel. Les études sur la stabilité du bois en service varient. A 12% d’humidité, le module de rupture est de 81–114 N/mm², le module d’élasticité de 13 400–14 500 N/mm², la compression axiale de 59–61 N/mm², la compression transversale de 14 N/mm², le cisaillement de 11,5–12 N/mm², la dureté Janka de flanc de 8370–9790 N, la dureté Janka en bout de 7740–8770 N et la dureté de flanc Chalais-Meudon de 6–9.
Si le bois est difficile à scier lorsqu’il est vert, en revanche une fois qu’il est sec, il se scie assez facilement. Il se travaille bien à la machine, mais les outils manuels ont tendance à déraper en raison des surfaces huileuses. Il est quelque peu difficile à raboter, mais se finit et se polit bien. Il ne se colle pas de manière satisfaisante, mais tient bien les clous et les vis. Il a de bonnes caractéristiques de tournage, mais se révèle cassant au mortaisage. Il supporte parfaitement les intempéries et résiste très bien à l’usure. Sa durabilité est élevée ; il résiste aux champignons, aux termites et aux térébrants marins. L’aubier résiste aux Lyctus.
Lors d’études menées au Swaziland, un extrait de l’écorce au mélange dichlorométhane-méthanol (1:1) a montré in vitro une activité antipaludéenne contre Plasmodium falciparum, mais aucune activité antibactérienne contre Escherichia coli. L’extrait n’a révélé d’effet toxique ni sur des hématies humaines ni sur des cellules épithéliales du rein. Lors d’études réalisées en Afrique du Sud, des extraits à l’acétone, à l’hexane, au dichlorométhane et au méthanol de l’écorce ont mis en lumière une action antifongique contre plusieurs champignons pathogènes de végétaux ou d’animaux, mais ces extraits contenaient des composés toxiques qui ont limité d’autant leur utilisation. On a remarqué que Breonadia salicina contenait un alcaloïde, la mitraphylline.
Description
- Arbre de taille petite à grande atteignant 40 m de haut, sempervirent ; fût jusqu’à 150 cm de diamètre, normalement à branches élancées à proximité de la base ; surface de l’écorce fissurée longitudinalement, écailleuse, grise à gris-brun, écorce interne fibreuse, rougeâtre, exsudant un jus visqueux ; cime étalée, dense ; rameaux glabres.
- Feuilles normalement disposées en verticilles de (2–)3–5 à l’extrémité des rameaux, simples et entières ; stipules interpétiolaires, triangulaires, longues de 4–6 mm, bifides, soudées à la base, caduques ; pétiole de 1–2,5 cm de long ; limbe lancéolé à étroitement elliptique, de 7–33 cm × 2–9 cm, cunéiforme à la base, aigu à légèrement acuminé à l’apex, coriace, glabre, pennatinervé à 16–25 paires de nervures latérales.
- Inflorescence : tête axillaire, solitaire, globuleuse, atteignant 1,5–2,5 cm de diamètre ; pédoncule de 9,5 cm de long, à pubescence courte, à 2–4 bractées ovales de 0,5–1 cm de long juste au-dessus du milieu.
- Fleurs bisexuées, régulières, 5-mères, petites, parfumées, sessiles, à nombreuses bractéoles longues de 3–5 mm entre les fleurs ; calice à tube de 1–2 mm de long et à lobes oblongs à linéaires ou triangulaires de 1–2,5(–4,5) mm de long ; corolle de 4–9 mm de long, blanche, rosée ou jaunâtre, poilue à l’extérieur, tube de 3–6,5 mm de long, lobes de 1–2,5 mm de long ; étamines insérées sur la gorge de la corolle ; ovaire infère, 2-loculaire, style de 1–1,5 cm de long, exsert, blanc, stigmate ellipsoïde ou capité, d’environ 0,5 mm de long, vert.
- Fruit : capsule ellipsoïde à obovoïde jusqu’à 5 mm de long, densément serrée en une infrutescence globuleuse, pubescente, déhiscente par 2 valves, à graines peu nombreuses.
- Graines obovoïdes, étroitement comprimées, de 2–3 mm de long.
Autres données botaniques
Le genre Breonadia est monotypique. Il faisait autrefois partie du genre Adina, qui est désormais limité à l’Asie.
Anatomie
Description anatomique du bois (codes IAWA pour les bois feuillus) :
- Cernes de croissance : 2 : limites de cernes indistinctes ou absentes.
- Vaisseaux : 5 : bois à pores disséminés ; 9 : vaisseaux exclusivement solitaires (à 90% ou plus) ; 13 : perforations simples ; 22 : ponctuations intervasculaires en quinconce ; 24 : ponctuations intervasculaires minuscules (très fines) (≤ 4μm) ; 29 : ponctuations ornées ; 30 : ponctuations radiovasculaires avec des aréoles distinctes ; semblables aux ponctuations intervasculaires en forme et en taille dans toute la cellule du rayon ; 41 : diamètre tangentiel moyen du lumen des vaisseaux 50–100 μm ; 42 : diamètre tangentiel moyen du lumen des vaisseaux 100–200 μm ; 47 : 5–20 vaisseaux par millimètre carré ; 48 : 20–40 vaisseaux par millimètre carré.
- Trachéides et fibres : 62 : fibres à ponctuations distinctement aréolées ; 63 : ponctuations des fibres fréquentes sur les parois radiales et tangentielles ; 66 : présence de fibres non cloisonnées ; 69 : fibres à parois fines à épaisses ; 70 : fibres à parois très épaisses.
- Parenchyme axial : 75 : parenchyme axial absent ou extrêmement rare ; 78 : parenchyme axial juxtavasculaire ; 92 : quatre (3–4) cellules par file verticale.
- Rayons : 97 : rayons 1–3-sériés (larges de 1–3 cellules) ; 100 : rayons avec des parties multisériées aussi larges que les parties unisériées ; 107 : rayons composés de cellules couchées avec 2 à 4 rangées terminales de cellules dressées et/ou carrées ; 108 : rayons composés de cellules couchées avec plus de 4 rangées terminales de cellules dressées et/ou carrées ; 113 : présence de cellules des rayons avec parois disjointes ; 116 : ≥ 12 rayons par mm.
Croissance et développement
Breonadia salicina a une croissance assez rapide, d’au moins 1 m par an en Afrique du Sud. Au Bénin, la floraison a lieu en février–août, les fruits mûrissant en juin–septembre. En Afrique australe, la floraison s’effectue en novembre–mars, la fructification en juin–juillet.
Ecologie
On trouve Breonadia salicina du niveau de la mer jusqu’à 1550 m d’altitude, habituellement dans les régions de savanes mais presque toujours à proximité de rivières et de cours d’eau, souvent dans la forêt-galerie, parfois dans des endroits rocailleux. A Madagascar, il est présent dans la forêt décidue sèche de même que dans la forêt sempervirente humide dans les zones où la pluviométrie annuelle moyenne est de 1000–2000 mm et qui comptent 4–6 mois secs, mais toujours en bord de rivière.
Multiplication et plantation
Breonadia salicina peut se multiplier par graines, mais on a observé que le taux de germination était bas. Ce sont les boutures et les sauvageons que l’on utilise plus souvent pour la plantation. Normalement, les boutures sont placées dans de la boue. Les jeunes plants de pépinière sont repiqués lorsqu’ils mesurent au moins 1 m de haut.
Gestion
Breonadia salicina est sensible à la concurrence des adventices. On a remarqué que les arbres recépaient bien. Au Mozambique, le diamètre minimum d’abattage autorisé est de 50 cm.
Ressources génétiques
Breonadia salicina est répandu et localement commun au sein de son aire. Il a donc peu de risques de souffrir d’érosion génétique. Au Malawi et en Afrique du Sud, cependant, l’espèce est protégée.
Perspectives
Breonadia salicina est un arbre polyvalent prisé tant pour son bois d’œuvre dur et durable que pour ses utilisations médicinales. Etant donné sa polyvalence et sa relative rapidité de croissance, il est recommandé de l’intégrer à des plantations agroforestières.
Références principales
- Arbonnier, M., 2004. Trees, shrubs and lianas of West African dry zones. CIRAD, Margraf Publishers Gmbh, MNHN, Paris, France. 573 pp.
- Bekele-Tesemma, A., 2007. Useful trees and shrubs for Ethiopia: identification, propagation and management for 17 agroclimatic zones. Technical Manual No 6. RELMA in ICRAF Project, Nairobi, Kenya. 552 pp.
- Bolza, E. & Keating, W.G., 1972. African timbers: the properties, uses and characteristics of 700 species. Division of Building Research, CSIRO, Melbourne, Australia. 710 pp.
- Bridson, D. & Verdcourt, B., 2003. Rubiaceae (Cinchonoideae). In: Pope, G.V. (Editor). Flora Zambesiaca. Volume 5, part 3. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 720 pp.
- Burkill, H.M., 1997. The useful plants of West Tropical Africa. 2nd Edition. Volume 4, Families M–R. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 969 pp.
- Coates Palgrave, K., 2002. Trees of southern Africa. 3rd Edition. Struik Publishers, Cape Town, South Africa. 1212 pp.
- Keay, R.W.J., 1989. Trees of Nigeria. A revised version of Nigerian trees (1960, 1964) by Keay, R.W.J., Onochie, C.F.A. & Stanfield, D.P. Clarendon Press, Oxford, United Kingdom. 476 pp.
- Neuwinger, H.D., 1998. Afrikanische Arzneipflanzen und Jagdgifte. Chemie, Pharmakologie, Toxikologie. 2nd Edition. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, Germany. 960 pp.
- Neuwinger, H.D., 2000. African traditional medicine: a dictionary of plant use and applications. Medpharm Scientific, Stuttgart, Germany. 589 pp.
- Takahashi, A., 1978. Compilation of data on the mechanical properties of foreign woods (part 3) Africa. Shimane University, Matsue, Japan. 248 pp.
Autres références
- Akoègninou, A., van der Burg, W.J. & van der Maesen, L.J.G. (Editors), 2006. Flore analytique du Bénin. Backhuys Publishers, Leiden, Netherlands. 1034 pp.
- Blaser, J., Rajoelison, G., Tsiza, G., Rajemison, M., Rabevohitra, R., Randrianjafy, H., Razafindrianilana, N., Rakotovao, G. & Comtet, S., 1993. Choix des essences pour la sylviculture à Madagascar. Akon’ny Ala: Bulletin du Département des Eaux et Forêts 12–13. 166 pp.
- Bryce, J.M., 1967. The commercial timbers of Tanzania. Tanzania Forest Division, Utilisation Section, Moshi, Tanzania. 139 pp.
- Chhabra, S.C., Mahunnah, R.L.A. & Mshiu, E.N., 1991. Plants used in traditional medicine in eastern Tanzania. 5. Angiosperms (Passifloraceae to Sapindaceae). Journal of Ethnopharmacology 33: 143–157.
- Guéneau, P., Bedel, J. & Thiel, J., 1970–1975. Bois et essences malgaches. Centre Technique Forestier Tropical, Nogent-sur-Marne, France. 150 pp.
- Hepper, F.N. & Keay, R.W.J., 1963. Rubiaceae. In: Hepper, F.N. (Editor). Flora of West Tropical Africa. Volume 2. 2nd Edition. Crown Agents for Oversea Governments and Administrations, London, United Kingdom. pp. 104–223.
- Hines, D.A. & Eckman, K., 1993. Indigenous multipurpose trees for Tanzania: uses and economic benefits for people. FAO Forestry Paper, Rome, Italy.
- Johnson, D. & Johnson, S., 2002. Down to Earth: Gardening with indigenous trees. Struik Publishers, Cape Town, South Africa. 112 pp.
- Kaufmann, J.C. & Elvin Lewis, M., 1995. Towards a logic of ethnodentistry at Antongobe, southwestern Madagascar. Economic Botany 49(2): 213–222.
- Lovett, J.C., Ruffo, C.K., Gereau, R.E. & Taplin, J.R.D., 2007. Field Guide to the moist forest trees of Tanzania. Frontier Publishing, United Kingdom. 303 pp.
- Lutze, M., 2001. Aspekte des Holzmarktes und der holzbearbeitenden Industrie einiger ausgewählter Provinzen Mosambiks. PhD thesis. Wissenschaftszentrum Weihenstephan für Ernährung, Landnutzung und Umwelt, Technischen Universität München, Germany. 184 pp.
- Mahlo, S.M., 2009. Characterization and biological activity of antifungal compounds present in Breonadia salicina (Rubiaceae) leaves. [Internet] PhD thesis, University of Pretoria, Pretoria, South Africa. 120 pp. http://upetd.up.ac.za/thesis/available/etd-05222010–172550. November 2011.
- Maliwichi, C.P., 2000. A study of medicinal plants used for maternal and child diseases in Malawi: an ethnobotanical perspective. UNESCO, Paris, France. 64 pp.
- Maliwichi-Nyirenda, C.P. & Maliwichi, L.L., 2010. Medicinal plants used for contraception and pregnancy related cases in Malawi: a case study of Mulanje. Journal of Medicinal Plants Research 4(20): 2121–2127.
- Offiah, N.V., Makama, S., Elisha, I.L., Makoshi, M.S., Gotep, J.G., Dawurung, C.J., Oladipo, O.O., Lohlum, A.S. & Shamaki, D., 2011. Ethnobotanical survey of medicinal plants used in the treatment of animal diarrhoea in Plateau State, Nigeria. BMC Veterinary Research 7: 36.
- Palmer, E. & Pitman, N., 1972–1974. Trees of southern Africa, covering all known indigenous species in the Republic of South Africa, South-West Africa, Botswana, Lesotho and Swaziland. 3 volumes. Balkema, Cape Town, South Africa. 2235 pp.
- Sibandze, G.F. & van Zyl, R.L., 2009. The antimalarial and toxicity studies of Swazi medicinal plants. [Internet] Abstracts of the World Congress on Medicinal and Aromatic Plants, Cape Town, November 2008. African Journal of Traditional, Complementary and Alternative Medicines (special issue). http://journals.sfu.ca/africanem/index.php/ajtcam/article/view/895. November 2011.
- Sibandze, G.F., van Zyl, R.L. & van Vuuren, S.F., 2010. The anti-diarrhoeal properties of Breonadia salicina, Syzygium cordatum and Ozoroa sphaerocarpa when used in combination in Swazi traditional medicine. Journal of Ethnopharmacology 132: 506–511.
- Teferi Flatie, Teferi Gedif, Kaleab Asres & Tsige Gebre-Mariam, 2009. Ethnomedical survey of Berta ethnic group Assosa Zone, Benishangul-Gumuz regional state, mid-west Ethiopia. Journal of Ethnobiology and Ethnomedicine 5: 14.
- van Wyk, B.E. & Gericke, N., 2000. People’s plants: a guide to useful plants of southern Africa. Briza Publications, Pretoria, South Africa. 351 pp.
Sources de l'illustration
- Akoègninou, A., van der Burg, W.J. & van der Maesen, L.J.G. (Editors), 2006. Flore analytique du Bénin. Backhuys Publishers, Leiden, Netherlands. 1034 pp.
Auteur(s)
- E.E. Ewudzie, Forestry Research Institute of Ghana (FORIG), University P.O. Box 63, KNUST, Kumasi, Ghana
- J.R. Cobbinah, Forestry Research Institute of Ghana (FORIG), University P.O. Box 63, KNUST, Kumasi, Ghana
- S. Britwum Acquah, Forestry Research Institute of Ghana (FORIG), University P.O. Box 63, KNUST, Kumasi, Ghana
- E.A. Obeng, Forestry Research Institute of Ghana (FORIG), University P.O. Box 63, KNUST, Kumasi, Ghana
Citation correcte de cet article
Ewudzie, E.E., Cobbinah, J.R., Britwum Acquah, S. & Obeng, E.A., 2012. Breonadia salicina (Vahl) Hepper & J.R.I.Wood. [Internet] Fiche de PROTA4U. Lemmens, R.H.M.J., Louppe, D. & Oteng-Amoako, A.A. (Editeurs). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Pays Bas. <http://www.prota4u.org/search.asp>.
Consulté le 23 décembre 2024.
- Voir cette page sur la base de données Prota4U.