Lathyrus sativus (PROTA) : Différence entre versions
| Ligne 4 : | Ligne 4 : | ||
| Répartition en Afrique= 2 | | Répartition en Afrique= 2 | ||
| Répartition mondiale= 1 | | Répartition mondiale= 1 | ||
| − | | Céréale / | + | | Céréale / légume sec= 2 |
| Légume= 1 | | Légume= 1 | ||
| Fourrage= 1 | | Fourrage= 1 | ||
| Ligne 11 : | Ligne 11 : | ||
| Sécurité alimentaire= 2 | | Sécurité alimentaire= 2 | ||
}} | }} | ||
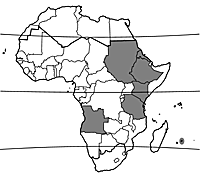
| − | + | [[File:Map Lathyrus sativus.gif|thumb|répartition en Afrique (cultivé)]] | |
| − | + | [[File:Linedrawing Lathyrus sativus.gif|thumb|1, rameau en fleurs et en fruits ; 2, graines. | |
| + | Source: PROSEA]] | ||
| + | [[File:Lathyrus sativus 6744.jpg|thumb|plante en fleurs]] | ||
| + | [[File:Lathyrus sativus 4-3 Dr. W.H. Schuster.jpg|thumb|fleur et fruits]] | ||
| + | [[File:Lathyrus sativus Nicola Centurione.jpg|thumb|fleurs]] | ||
| + | [[File:Lathyrus sativus 4-5 Dr. W.H. Schuster.jpg|thumb|fruits secs]] | ||
| + | [[File:Lathyrus sativus 4-6 Dr. W.H. Schuster.jpg|thumb|graines]] | ||
| + | [[File:Lathyrus sativus 6743.jpg|thumb|culture arrivant à maturité]] | ||
<big>''[[Lathyrus sativus]]'' L.</big> | <big>''[[Lathyrus sativus]]'' L.</big> | ||
| − | |||
__NOTOC__ | __NOTOC__ | ||
| − | |||
| − | |||
{{DISPLAYTITLE:''Lathyrus sativus'' (PROTA)}} | {{DISPLAYTITLE:''Lathyrus sativus'' (PROTA)}} | ||
| − | |||
:Protologue: Sp. pl. 2 : 730 (1753). | :Protologue: Sp. pl. 2 : 730 (1753). | ||
| Ligne 25 : | Ligne 28 : | ||
:Nombre de chromosomes: 2''n'' = 14 | :Nombre de chromosomes: 2''n'' = 14 | ||
| − | |||
| − | |||
| − | |||
| − | |||
== Noms vernaculaires == | == Noms vernaculaires == | ||
| − | Gesse, gesse blanche, gesse commune, pois carré, lentille d’Espagne (Fr). Grass pea, chickling pea, chickling vetch, white pea (En). Chícharo, chícharo comun, sincho (Po). | + | *Gesse, gesse blanche, gesse commune, pois carré, lentille d’Espagne (Fr). |
| + | *Grass pea, chickling pea, chickling vetch, white pea (En). | ||
| + | *Chícharo, chícharo comun, sincho (Po). | ||
== Origine et répartition géographique == | == Origine et répartition géographique == | ||
| Ligne 58 : | Ligne 59 : | ||
== Description == | == Description == | ||
| − | Plante herbacée annuelle fortement ramifiée, érigée, rampante ou grimpante, glabre ; tige mince, carrée, ailée, atteignant 90(–170) cm de long ; racine pivotante bien développée. Feuilles alternes, 2- ou 4-foliolées, se terminant en une vrille simple ou ramifiée ; stipules proéminentes, foliacées, étroitement triangulaires, pourvues d’un appendice basal plus petit mais de forme similaire et souvent d’une petite dent entre les lobes ; pétiole souvent ailé, de (1–)1,5–2,5(–3,5) cm de long ; folioles sessiles, étroitement elliptiques-oblongues, de (3–)4–5(–7,5) cm × 3–5(–13) mm, cunéiformes à la base, aiguës ou acuminées à l’apex. Fleurs solitaires à l’aisselle des feuilles, bisexuées, papilionacées, pédicelle articulé, partie inférieure de (1–)3–3,5 (–5) cm de long, partie supérieure de (2–)5–7(–8) mm de long ; calice campanulé, tube d’environ 3 mm de long, lobes 5, presque égaux, étroitement triangulaires, de 3–6 mm de long ; corolle bleue, rougeâtre-violette, rouge, rose ou blanche, étendard érigé et étalé, très largement obovale, d’environ 15 mm × 18 mm, à onglet, rétus au sommet, ailes largement obovales, d’environ 14 mm × 8 mm, à onglet et à auricule, carène légèrement torse, en forme de coque de bateau, d’environ 10 mm × 7 mm, à onglet et à 2 auricules ; étamines 10, dont 9 réunies et 1 libre ; ovaire supère, sessile, d’environ 6 mm de long, style brusquement tourné vers le haut, d’environ 7 mm de long, stigmate en forme de cuillère. Fruit : gousse oblongue et aplatie de (1,5–)2,5–4,5 (–5,5) cm × 0,5–2 cm, bord supérieur à 2 ailes et à bec court, glabre, à (1–)2–5(–7) graines. Graines en forme de coin, de 4–7 mm de diamètre, blanches, vert pâle, grises ou brunes, marbrées ; hile elliptique. Plantule à germination hypogée. | + | *Plante herbacée annuelle fortement ramifiée, érigée, rampante ou grimpante, glabre ; tige mince, carrée, ailée, atteignant 90(–170) cm de long ; racine pivotante bien développée. |
| + | *Feuilles alternes, 2- ou 4-foliolées, se terminant en une vrille simple ou ramifiée ; stipules proéminentes, foliacées, étroitement triangulaires, pourvues d’un appendice basal plus petit mais de forme similaire et souvent d’une petite dent entre les lobes ; pétiole souvent ailé, de (1–)1,5–2,5(–3,5) cm de long ; folioles sessiles, étroitement elliptiques-oblongues, de (3–)4–5(–7,5) cm × 3–5(–13) mm, cunéiformes à la base, aiguës ou acuminées à l’apex. | ||
| + | *Fleurs solitaires à l’aisselle des feuilles, bisexuées, papilionacées, pédicelle articulé, partie inférieure de (1–)3–3,5 (–5) cm de long, partie supérieure de (2–)5–7(–8) mm de long ; calice campanulé, tube d’environ 3 mm de long, lobes 5, presque égaux, étroitement triangulaires, de 3–6 mm de long ; corolle bleue, rougeâtre-violette, rouge, rose ou blanche, étendard érigé et étalé, très largement obovale, d’environ 15 mm × 18 mm, à onglet, rétus au sommet, ailes largement obovales, d’environ 14 mm × 8 mm, à onglet et à auricule, carène légèrement torse, en forme de coque de bateau, d’environ 10 mm × 7 mm, à onglet et à 2 auricules ; étamines 10, dont 9 réunies et 1 libre ; ovaire supère, sessile, d’environ 6 mm de long, style brusquement tourné vers le haut, d’environ 7 mm de long, stigmate en forme de cuillère. | ||
| + | *Fruit : gousse oblongue et aplatie de (1,5–)2,5–4,5 (–5,5) cm × 0,5–2 cm, bord supérieur à 2 ailes et à bec court, glabre, à (1–)2–5(–7) graines. | ||
| + | *Graines en forme de coin, de 4–7 mm de diamètre, blanches, vert pâle, grises ou brunes, marbrées ; hile elliptique. | ||
| + | *Plantule à germination hypogée. | ||
== Autres données botaniques == | == Autres données botaniques == | ||
| Ligne 186 : | Ligne 192 : | ||
== Auteur(s) == | == Auteur(s) == | ||
| − | * S.S. Yadav | + | * S.S. Yadav, Division of Genetics, Indian Agricultural Research Institute, New Delhi 110012, India |
| − | + | ||
| − | Division of Genetics, Indian Agricultural Research Institute, New Delhi 110012, India | + | |
| − | * G. Bejiga | + | * G. Bejiga, Green Focus Ethiopia, P.O. Box 802, Addis Ababa, Ethiopia |
| − | + | == Citation correcte de cet article == | |
| − | Consulté le {{CURRENTDAY}} {{CURRENTMONTHNAME}} {{CURRENTYEAR}}. | + | Yadav, S.S. & Bejiga, G., 2006. '''Lathyrus sativus''' L. In: Brink, M. & Belay, G. (Editors). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Netherlands. Consulté le {{CURRENTDAY}} {{CURRENTMONTHNAME}} {{CURRENTYEAR}}. |
Version actuelle en date du 26 août 2015 à 20:54
Introduction |
| Importance générale | |
| Répartition en Afrique | |
| Répartition mondiale | |
| Céréale / légume sec | |
| Légume | |
| Oléagineux | |
| Médicinal | |
| Fourrage | |
| Sécurité alimentaire | |
- Protologue: Sp. pl. 2 : 730 (1753).
- Famille: Papilionaceae (Leguminosae - Papilionoideae, Fabaceae)
- Nombre de chromosomes: 2n = 14
Noms vernaculaires
- Gesse, gesse blanche, gesse commune, pois carré, lentille d’Espagne (Fr).
- Grass pea, chickling pea, chickling vetch, white pea (En).
- Chícharo, chícharo comun, sincho (Po).
Origine et répartition géographique
L’origine de Lathyrus sativus est inconnue. Il existe des mentions de plantes sauvages de Lathyrus sativus en Irak, mais on ne sait pas bien s’il s’agit de plantes vraiment sauvages ou échappées des cultures. Lathyrus sativus dérive peut-être de Lathyrus cicera L., qui est présent à l’état sauvage en Europe méridionale, en Afrique du Nord et à l’ouest de l’Asie, et où il est parfois cultivé. La domestication de la gesse a probablement eu lieu dans les Balkans vers 6000 avant J.-C. Des restes de Lathyrus sativus remontant à 2000–1500 avant J.-C. sont signalés en Inde. De nos jours, la gesse est largement cultivée sur de vastes régions en Asie (en particulier le Bangladesh, l’Inde, le Népal, le Pakistan et le Proche-Orient), en Europe méridionale et en Afrique du Nord, et dans une moindre mesure en Amérique, en Australie et en Afrique du Sud. En Afrique tropicale, elle est surtout cultivée en Ethiopie, mais également au Soudan, en Erythrée, au Kenya, en Tanzanie, en Angola et à l’île Maurice.
Usages
En Ethiopie et en Erythrée, les graines de gesse se consomment surtout sous forme de sauces (les “wot”) ; le “shiro wot” (sauce à base de farine) et le “kik wot” (sauce à base de graines cassées décortiquées) se mangent avec l’ “injera” (grande crêpe utilisée comme pain). Les graines de gesse cuites à l’eau (“nifro”) sont aussi consommées dans la plupart des régions, tandis que la “kitta” (un pain non levé) à base de graines de gesse, se consomme surtout en période de pénurie alimentaire aiguë. En Inde, on fait cuire les graines entières à l’eau, mais la plupart du temps, on en fait du dal. La farine, produite en broyant les graines entières ou cassées, se vend sous le nom de “besan”. Au Bangladesh, le “roti” à base de farine de gesse constitue la nourriture de base des ouvriers agricoles sans terre. En Inde, la gesse est parfois vendue frauduleusement à la place du pois chiche ou du pois cajan, qui sont des légumes secs plus chers. Mais il faut faire attention lorsque l’on mange des graines de gesse car une consommation excessive entraîne des troubles neurologiques chez les humains et chez les animaux, que l’on appelle lathyrisme et qui se caractérise par une paralysie des membres inférieurs. Dans de nombreux pays, les graines de gesse servent d’aliment pour les animaux, par ex. elles entrent dans la composition des aliments de démarrage et de croissance des porcs.
En Asie, les gousses immatures sont cuisinées et consommées comme légume, ou bien elles servent d’amuse-gueule, une fois cuites à l’eau et salées. Les parties végétatives jeunes se préparent comme légume vert ; on les fait également sécher pour les employer comme légume hors saison. Les jeunes plantes de gesse servent de fourrage pour le bétail ou de pâture dans de nombreux pays. Les tiges et la balle qui subsistent après la récolte sont souvent la principale raison de la culture de cette plante en Asie. S’il s’agit de fourrage, les plantes peuvent se manger vertes ou en foin ; elles ne peuvent pas être ensilées. La gesse se cultive comme engrais vert, par ex. en Australie et au Canada. L’huile des graines a des applications en médecine, où elle sert de cathartique puissant.
Production et commerce international
Selon des estimations, l’Inde a produit environ 0,8 million de t de graines de gesse par an sur 1,5 million d’ha au milieu des années 1990 ; au Bangladesh en revanche, la production était inférieure (175 000 t sur 240 000 ha) ainsi qu’au Pakistan (45 000 t sur 130 000 ha). Vers la fin des années 1990, la production en Ethiopie a été estimée à 105 000 t sur 142 000 ha. En tant que grain alimentaire, la gesse est traditionnellement commercialisée à l’intérieur de sa zone de production et n’entre pas dans le commerce international.
Propriétés
La composition des graines entières de gesse, par 100 g de partie comestible, est : eau 8,4 g, énergie 1457 kJ (348 kcal), protéines 27,4 g, lipides 1,1 g, glucides 59,8 g, fibres 7,3 g, Ca 127 mg, P 410 mg et Fe 10,0 mg (Leung, Busson & Jardin, 1968). La gesse est nettement déficiente en méthionine et tryptophane. Les graines entières crues contiennent 41% d’amidon sur la matière sèche ; les granules d’amidon, de forme ovale, font en moyenne 25 μm de long et 17 μm de large.
L’affection neurologique appelée lathyrisme est provoqué par un acide aminé non protéique soluble dans l’eau, l’ODAP (acide β-N-oxalyl- L-α,β-diaminopropionique), également connu sous les sigles BOAA (β- N-oxalylamino-L-alanine) et OAP (acide L-3-oxalylamino-2-aminopropionique). Présent dans toutes les parties de la plante, l’ODAP affecte différentes parties du système nerveux central, en interrompant la neurotransmission et en détériorant l’activité musculaire. A ses débuts, le lathyrisme peut être aussi bien lent que soudain ; il se manifeste souvent par une sensation de lourdeur et de douleurs des membres inférieurs. C’est une maladie souvent irréversible, mais non mortelle. Il semble qu’elle survienne lorsque la quantité de gesse ingérée est d’au moins 25% du régime, et que la consommation se prolonge sur 1,5–6 mois ; la maladie peut alors toucher jusqu’à 5% de la population. Les cas de lathyrisme se déclarent souvent au cours de quasi famines, qui forcent les gens à trop s’en remettre à la gesse. Classiquement, la teneur des graines de gesse en ODAP varie de 0,1–1,4(–2,5) g par 100 g de graines. Les niveaux d’ODAP ne sont pas seulement déterminés génétiquement, ils dépendent aussi largement des conditions culturales. En général, le trempage et la cuisson des graines à l’eau réduisent leur niveau d’ODAP, et cet effet est renforcé si on change l’eau après trempage et en cours de cuisson. Lorsque les graines sont réduites en farine, celle-ci étant utilisée en pâtisserie ou en cuisine, il est possible que l’ODAP y subsiste. Malheureusement, les traitements efficaces de détoxication aboutissent souvent à une baisse de la qualité nutritionnelle. Parmi les autres facteurs antinutritionnels chez la gesse, il faut citer les inhibiteurs de trypsine, les tanins, les lectines, des phytates et des oligosaccharides.
Le foin de gesse contient : eau 14,6%, protéines 9,9%, lipides 1,9%, fibres 36,5%, extrait sans azote 31,0% et cendres 6,1%. Les graines de cultivars dont la proportion d’ODAP atteint 0,22 g par 100 g de graines pourraient faire partie des aliments de croissance des poulets à raison de 400 g de graines de gesse par kg d’aliment, sans effet négatif sur la prise de poids, ou la digestibilité des lipides ou des protéines.
Description
- Plante herbacée annuelle fortement ramifiée, érigée, rampante ou grimpante, glabre ; tige mince, carrée, ailée, atteignant 90(–170) cm de long ; racine pivotante bien développée.
- Feuilles alternes, 2- ou 4-foliolées, se terminant en une vrille simple ou ramifiée ; stipules proéminentes, foliacées, étroitement triangulaires, pourvues d’un appendice basal plus petit mais de forme similaire et souvent d’une petite dent entre les lobes ; pétiole souvent ailé, de (1–)1,5–2,5(–3,5) cm de long ; folioles sessiles, étroitement elliptiques-oblongues, de (3–)4–5(–7,5) cm × 3–5(–13) mm, cunéiformes à la base, aiguës ou acuminées à l’apex.
- Fleurs solitaires à l’aisselle des feuilles, bisexuées, papilionacées, pédicelle articulé, partie inférieure de (1–)3–3,5 (–5) cm de long, partie supérieure de (2–)5–7(–8) mm de long ; calice campanulé, tube d’environ 3 mm de long, lobes 5, presque égaux, étroitement triangulaires, de 3–6 mm de long ; corolle bleue, rougeâtre-violette, rouge, rose ou blanche, étendard érigé et étalé, très largement obovale, d’environ 15 mm × 18 mm, à onglet, rétus au sommet, ailes largement obovales, d’environ 14 mm × 8 mm, à onglet et à auricule, carène légèrement torse, en forme de coque de bateau, d’environ 10 mm × 7 mm, à onglet et à 2 auricules ; étamines 10, dont 9 réunies et 1 libre ; ovaire supère, sessile, d’environ 6 mm de long, style brusquement tourné vers le haut, d’environ 7 mm de long, stigmate en forme de cuillère.
- Fruit : gousse oblongue et aplatie de (1,5–)2,5–4,5 (–5,5) cm × 0,5–2 cm, bord supérieur à 2 ailes et à bec court, glabre, à (1–)2–5(–7) graines.
- Graines en forme de coin, de 4–7 mm de diamètre, blanches, vert pâle, grises ou brunes, marbrées ; hile elliptique.
- Plantule à germination hypogée.
Autres données botaniques
Le genre Lathyrus comprend environ 150 espèces, principalement dans les régions tempérées de l’hémisphère Nord et en Amérique du Sud ; il y a quelques espèces en Afrique. Lathyrus sativus est situé dans la section Lathyrus de même qu’une trentaine d’autres espèces annuelles ou vivaces. Sur la base de leur capacité à s’hybrider et de données cytologiques, Lathyrus amphicarpos Gouan et Lathyrus cicera L. ont été placés dans le pool génique secondaire de la gesse. Plus récemment, on a réussi à obtenir des croisements entre Lathyrus sativus et Lathyrus pseudocicera Pamp. Lathyrus sativus mis à part, les autres espèces de Lathyrus cultivées en Ethiopie sont la plante ornementale Lathyrus odoratus L. et la plante fourragère Lathyrus aphaca L.
La classification infraspécifique repose essentiellement sur la couleur des fleurs, les marques sur les gousses et la taille et la couleur des graines. En général, les graines blanches sont les plus prisées pour la consommation humaine. Le taux de variabilité infraspécifique d’après les marqueurs RAPD est faible comparé à celui d’autres légumineuses à graines telles que la lentille et le pois. A partir d’une analyse d’isozymes, on a découvert que la variabilité la plus élevée était en Asie occidentale et en Afrique du Nord.
Croissance et développement
C’est aux alentours de 20°C que la germination des graines de gesse est la plus rapide. La floraison intervient 1,5–4 mois après le semis. La biologie florale de la gesse favorise l’autogamie (les anthères sont habituellement déhiscentes avant l’ouverture complète de la fleur), mais de nombreux cas d’allogamie importante (jusqu’à 28%) ont été signalés. Le cycle cultural complet est de 3–6 mois. La gesse nodule efficacement avec Rhizobium leguminosarum.
Ecologie
La gesse réussit bien dans les régions où la pluviométrie annuelle est de 400–650 mm/an et où la température moyenne est de 10–25°C. Elle supporte les fortes pluies en début de croissance, et une sécheresse prolongée lors du remplissage du grain. Elle pousse bien dans les régions subtropicales comme culture d’hiver. La gesse se cultive sur de nombreux types de sols, y compris les sols pauvres et les argiles lourdes. Elle tolère l’asphyxie racinaire et une salinité modérée. En Ethiopie, la gesse est souvent cultivée en saison sèche sur l’humidité résiduelle dans les sols noirs argileux lourds, à 1700–2700 m d’altitude. En Inde, c’est une culture de saison froide, jusqu’à 1200 m d’altitude.
Multiplication et plantation
La gesse se multiplie par graines. Le poids de 1000 graines est de 30–300 g. En Ethiopie, le lit de semis n’a pas besoin d’être fin ; 1–2 labours suffisent. La densité moyenne de semis est habituellement de 45–60 kg/ha pour une culture pure, et d’environ 35 kg/ha en association. On sème les graines à la volée ou en sillons après les avoir éventuellement fait tremper dans l’eau pendant une nuit. Des densités de 200 000–250 000 plantes/ha sont courantes. En Ethiopie, la gesse est généralement semée en septembre–novembre et récoltée en janvier–avril.
La gesse se cultive soit en culture pure, soit en association, par ex. avec de l’orge, du lin ou des pois chiches. Dans de nombreux pays, la gesse est produite dans des systèmes de riziculture, avant ou en alternance avec le riz. En Inde, la gesse est souvent cultivée comme culture de relais : elle se sème à la volée dans une culture de riz sur pied, 2 semaines environ avant la récolte du riz, et on la fait pousser sur l’humidité résiduelle.
Gestion
Souvent, la gesse ne reçoit pratiquement aucun soin après avoir été semée, bien que pour des rendements optimaux, il vaut mieux enlever le gros des mauvaises herbes. Dans un champ bien préparé, la culture se développe en une masse épaisse et couvre toute la surface du sol, étouffant ainsi les adventices. D’habitude, la gesse ne reçoit pas d’engrais, mais des taux de fixation d’azote atmosphérique de 25–50 kg/ha ont été enregistrés. En Ethiopie, la gesse se cultive en rotation après l’orge ou parfois après un légume sec, tel que pois ou pois chiche, semé en avril et récolté en juillet.
Maladies et ravageurs
Les principales maladies de la gesse sont l’oïdium (Erysiphe pisi) et le mildiou (Peronospora spp.), mais ce dernier n’apparaît pas en Ethiopie. Des cas de rouille (Uromyces fabae) et de fusariose (Fusarium oxysporum) ont été rapportés en Ethiopie. Le virus de la jaunisse nécrotique de la fève (FBNYV) a été observé sur la gesse en Ethiopie ; il se transmet par les pucerons Acyrtosiphon pisum et Aphis craccivora. Dans des études de spectre d’hôtes, on a découvert que la gesse était sensible au virus de la mosaïque du pois transmis par graines (PSbMV). Les pucerons et les thrips comptent parmi les insectes ravageurs de la gesse. Le puceron du pois (Acyrthosiphon pisum) est son principal ravageur en Ethiopie.
Récolte
La récolte de la gesse doit être effectuée lorsque les feuilles jaunissent et que les gousses virent au gris, pour éviter l’égrenage. Les plantes s’arrachent à la main ou se coupent à la faucille à la base. Puis on les met en meules et on les laisse sécher 7–8 jours au champ ou sur l’aire de battage.
Rendement
Le rendement moyen en graines de gesse est de 350–700 kg/ha ; en Ethiopie, il avoisine les 700 kg/ha. Lors d’essais de production menés récemment dans différents pays, on a fait état de niveaux de rendements de 1500–3000 kg/ha.
Traitement après récolte
Le battage des gousses s’effectue par dépiquage avec des animaux, ou à l’aide de bâtons ; ensuite on procède au vannage et au nettoyage des graines. On peut faire sécher les graines quelques jours avant de les stocker.
Ressources génétiques
L’ICARDA (Alep, Syrie) détient une collection de Lathyrus d’environ 1880 entrées, dont 1560 appartiennent à l’espèce Lathyrus sativus. D’importantes collections de ressources génétiques de gesse sont également conservées en France (IBEAS, Laboratoire d’écologie moléculaire de l’Université de Pau ; 1810 entrées), en Australie (Australian Temperate Field Crops Collection, Horsham, Victoria ; 844 entrées), en Russie (Institut Vavilov, à St. Petersbourg ; 688 entrées), au Bangladesh (Plant Genetic Resources Centre, Bangladesh Agricultural Research Institute (BARI), à Joydebpour, Gazipour ; 584 entrées) et aux Etats-Unis (à l’USDA/ARS Western Regional Plant Introduction Station de Pullman, à Washington ; 248 entrées). En Afrique tropicale, des collections de ressources génétiques sont conservées en Ethiopie (197 entrées à l’Institute of Biodiversity Conservation d’Addis Abeba ; 13 entrées à l’Institut international de recherche sur le bétail (ILRI) d’Addis Abeba) et au Kenya (National Genebank of Kenya, Crop Plant Genetic Resources Centre, KARI, à Kikuyu ; 4 entrées). Au stockage, les graines de gesse présentent un comportement orthodoxe.
Sélection
L’objectif principal pour l’amélioration génétique de la gesse est la réduction des niveaux d’ODAP ; c’est la meilleure méthode pour obtenir un produit sans danger. Deuxièmement, l’augmentation du potentiel génétique en termes de rendement est un but important. Les autres objectifs d’amélioration sont l’incorporation d’une résistance aux maladies et l’augmentation de la taille des graines, une maturité plus précoce et un indice de récolte plus élevé. Des lignées possédant une résistance moyenne à l’oïdium ont été identifiées. En Ethiopie, un grand nombre d’entrées et de lignées de sélection provenant de l’ICARDA sont résistantes à l’oïdium.
Mais chez la gesse, les améliorations ont pris du temps. En Afrique, il n’y a encore sur le marché aucun cultivar amélioré à haut rendement, à faible teneur en ODAP et doté de résistance aux stress biotiques et abiotiques. Mais en Inde, il y a eu quelques tentatives pour fournir des cultivars améliorés à faible teneur en ODAP. Au Chili et au Bengladesh, des lignées prometteuses ont également été identifiées, à faible taux d’ODAP et à haut rendement. Récemment, sur les 13 lignées à faible teneur en ODAP identifiées en Ethiopie, trois lignées introduites et provenant de l’ICARDA ont constamment présenté des taux d’ODAP faibles et de bons rendements pendant trois années consécutives. Cependant, le taux important d’allogamie chez la gesse a limité les progrès dans l’identification de lignées stables à faible teneur en ODAP ; la multiplication des graines des lignées sélectionnées doit se faire en isolement, et elles doivent être fournies aux paysans chaque année.
Une embryogenèse somatique indirecte (à partir de tissus) est possible chez la gesse à l’aide de méristèmes apicaux, de bourgeons axillaires et d’explants de tiges, de feuilles et de racines. L’embryogenèse somatique directe a été réalisée à partir de folioles immatures et de segments nodaux. Des somaclones combinant une faible teneur en ODAP et un rendement élevé ont été créés. Les autres approches biotechnologiques pour obtenir des types de gesses à faible teneur en ODAP concernent l’incorporation de gènes dégradeurs d’ODAP à partir de microbes, et l’emploi de la technologie antisens pour réprimer les gènes responsables de la biosynthèse de l’ODAP. Des plantes de gesse transgéniques ont été produites par bombardement des explants avec des particules enrobées d’ADN. Des cartes de liaison génétique du génome de Lathyrus sativus ont été dressées à l’aide de différents marqueurs moléculaires (RAPD, STMS et STS/CAPS), et des locus de caractères quantitatifs associés à une résistance à l’ascochytose (Mycosphaerella pinodes) ont été localisés pour réaliser le transfert éventuel de ce caractère chez l’espèce apparentée Pisum sativum L.
Perspectives
La gesse est la moins prisée des légumineuses alimentaires communes, mais elle possède un certain nombre de caractéristiques qui la rendent intéressante, en particulier pour les paysans sans ressources, à cause de son adaptation à des conditions difficiles comme la sécheresse et l’engorgement des sols. Par conséquent, cela fait d’elle une culture utile pour des sols secs et pauvres et une plante de secours lorsque les autres cultures ont échoué. Toutefois, la présence dans les graines de la toxine ODAP est un inconvénient sérieux, qui pose un réel danger pour la santé des consommateurs. La culture de la gesse est souvent déconseillée, et elle a parfois même été interdite, par ex. dans certains Etats de l’Inde, mais cela a été sans effet en l’absence d’alternative bon marché. Par conséquent, la priorité dans l’amélioration génétique de la gesse est la création de cultivars à haut rendement à faible teneur en ODAP, qui puissent être consommés sans risque. Par ailleurs, il est nécessaire d’approfondir les recherches pour trouver des méthodes efficaces de détoxication qui ne réduisent pas la valeur nutritionnelle des graines.
Références principales
- Campbell, C.G., 1997. Grasspea (Lathyrus sativus L.). Promoting the conservation and use of underutilized and neglected crops No 18. Institute of Plant Genetics and Crop Plant Research, Gatersleben, Germany / International Plant Genetic Resources Institute, Rome, Italy. 92 pp.
- Campbell, C.G., Mehra, R.B., Agrawal, S.K., Chen, Y.Z., Abdel-Moneim, A.M., Khawaja, H.I.T., Yadov, C.R., Tay, J.U. & Araya, W.A., 1994. Current status and future strategy in breeding grasspea (Lathyrus sativus L.). Euphytica 73: 167–175.
- Jansen, P.C.M., 1989. Lathyrus sativus L. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 50–51.
- Kay, D.E., 1979. Food legumes. Crops and Product Digest No 3. Tropical Products Institute, London, United Kingdom. 435 pp.
- Kearney, J. & Smartt, J., 1995. The grasspea. In: Smartt, J. & Simmonds, N.W. (Editors). Evolution of crop plants. 2nd Edition. Longman, London, United Kingdom. pp. 266–270.
- Kislev, M.E., 1989. Origins of the cultivation of Lathyrus sativus and L. cicera (Fabaceae). Economic Botany 43(2): 262–270.
- Knight, R. (Editor), 2000. Linking research and marketing opportunities for pulses in the 21st century. Proceedings of the third international food legumes research conference. Kluwer Academic Publishers, Dordrecht, Netherlands. 800 pp.
- Muehlbauer, F.J. & Kaiser, W.J. (Editors), 1994. Expanding the production and use of cool season food legumes: a global perspective of persistent constraints and of opportunities and strategies for further increasing the productivity and use of pea, lentil, faba bean, chickpea and grasspea in different farming systems. Proceedings of the second international food legume research conference on pea, lentil, faba bean, chickpea, and grasspea, Cairo, Egypt, 12–16 April 1992. Kluwer Academic Publishers, Dordrecht, Netherlands. 991 pp.
- Smartt, J., 1984. Evolution of grain legumes. I. Mediterranean pulses. Experimental Agriculture 20: 275–296.
- Westphal, E., 1974. Pulses in Ethiopia, their taxonomy and agricultural significance. Agricultural Research Reports 815. Centre for Agricultural Publishing and Documentation, Wageningen, Netherlands. 263 pp.
Autres références
- Akalu, G., Tufvesson, F., Jönsson, C. & Nair, B.M., 1998. Physico-chemical characteristics and functional properties of starch and dietary fibre in grass pea seeds. Starch 50: 374–382.
- Barna, K.S. & Mehta, S.L., 1995. Genetic transformation and somatic embryogenesis in Lathyrus sativus. Journal of Plant Biochemistry and Biotechnology 4: 67–71.
- Chowdhury, M.A. & Slinkard, A.E., 2000. Genetic diversity in grasspea (Lathyrus sativus L.). Genetic Resources and Crop Evolution 47: 163–169.
- Croft, A.M., Pang, E.C.K. & Taylor, P.W.J., 1999. Molecular analysis of Lathyrus sativus L. (grasspea) and related Lathyrus species. Euphytica 107(3): 167–176.
- Dadi, L., Teklewold, H., Aw-Hassan, A., Abdel Moneim, A.M. & Bejiga, G., 2003. The socio economic factors affecting grass pea consumption and the incidence of lathyrism in Ethiopia. Integrated Natural Resource Management: Technical Research Report Series, No 4. ICARDA, Aleppo, Syria. 55 pp.
- Getahun, H., Lambein, F. & Vanhoorne, M., 2002. Neurolathyrism in Ethiopia: assessment and comparison of knowledge and attitude of health workers and rural inhabitants. Social Science & Medicine 54: 1513–1524.
- Getahun, H., Lambein, F., Vanhoorne, M. & van der Stuyft, P., 2002. Pattern and associated factors of the neurolathyrism epidemic in Ethiopia. Tropical Medicine and International Health 7(2): 118–124.
- Hanbury, C.D., White, C.L., Mullan, B.P. & Siddique, K.H.M., 2000. A review of the potential of Lathyrus sativus L. and L. cicera L. grain for use as animal feed. Animal Feed Science and Technology 87: 1–27.
- ILDIS, 2002. World database of Legumes, Version 6,05. International Legume Database & Information Service. [Internet] http://www.ildis.org/. September 2004.
- Leung, W.-T.W., Busson, F. & Jardin, C., 1968. Food composition table for use in Africa. FAO, Rome, Italy. 306 pp.
- Mehta, S.L., Ali, K. & Barna, K.S., 1994. Somaclonal variation in a food legume - Lathyrus sativus. Journal of Plant Biochemistry & Biotechnology 3: 73–77.
- Mehta, S.L. & Santha, I.M., 1996. Plant biotechnology for development of non-toxic strains of Lathyrus sativus. In: Arora, R.K., Mathur, P.N., Riley, K.W. & Adham, Y. (Editors). 1996. Lathyrus genetic resources in Asia: proceedings of a regional workshop, 27–29 December 1995, Indira Gandhi Agricultural University, Raipur, India. IPGRI Office for South Asia, New Delhi, India. pp. 129–138.
- Mondal, A.K., Parui, S., Nandi, J.B. & Mandal, S., 1998. Studies on the effect of temperature on the germination of seeds. Indian Journal of Plant Physiology 3(2): 168–171.
- Rotter, R.G., Marquardt, R.R. & Campbell, C.G., 1991. The nutritional value of low lathyrogenic Lathyrus (Lathyrus sativus) for growing chicks. British Poultry Science 32: 1055–1067.
- Skiba, B., Ford, R. & Pang, E.C.K., 2004. Construction of a linkage map based on a Lathyrus sativus backcross population and preliminary investigation of QTLs associated with resistance to ascochyta blight. Theoretical and Applied Genetics 109(8): 1726–1735.
- Spencer, P.S., 1994. Human consumption of plant materials with neurotoxic potential. Acta Horticulturae 375: 341–348.
- Tekle Haimanot, R., Abegaz, B., Wuhib, E., Kassina, A., Kidane, Y., Kebede, N., Alemu, T. & Spencer, P.S., 1993. Nutritional and neuro-toxicological surveys of Lathyrus sativus consumption in northern Ethiopia. In: Yusuf, H.K.M. & Lambein, F. (Editors). Lathyrus sativus and human lathyrism: progress and prospects. Proceedings of the 2nd International Colloquium Lathyrus/Lathyrism, Dhaka, 10–12 December, 1993. University of Dhaka, Dhaka, Bangladesh. pp. 41–45.
- Thulin, M., 1989. Fabaceae (Leguminosae). In: Hedberg, I. & Edwards, S. (Editors). Flora of Ethiopia. Volume 3. Pittosporaceae to Araliaceae. The National Herbarium, Addis Ababa University, Addis Ababa, Ethiopia and Department of Systematic Botany, Uppsala University, Uppsala, Sweden. pp. 49–251.
- Wuletaw, T. & Endashaw, B., 2003. Variation and association of morphological and biochemical characters in grass pea (Lathyrus sativus L.). Euphytica 130(3): 315–324.
- Yunus, A.G. & Jackson, M.T., 1991. The genepools of the grasspea (Lathyrus sativus L.). Plant Breeding 106: 319–328.
Sources de l'illustration
- Jansen, P.C.M., 1989. Lathyrus sativus L. In: van der Maesen, L.J.G. & Somaatmadja, S. (Editors). Plant Resources of South-East Asia No 1. Pulses. Pudoc, Wageningen, Netherlands. pp. 50–51.
Auteur(s)
- S.S. Yadav, Division of Genetics, Indian Agricultural Research Institute, New Delhi 110012, India
- G. Bejiga, Green Focus Ethiopia, P.O. Box 802, Addis Ababa, Ethiopia
Citation correcte de cet article
Yadav, S.S. & Bejiga, G., 2006. Lathyrus sativus L. In: Brink, M. & Belay, G. (Editors). PROTA (Plant Resources of Tropical Africa / Ressources végétales de l’Afrique tropicale), Wageningen, Netherlands. Consulté le 23 décembre 2024.
- Voir cette page sur la base de données Prota4U.