Momordica charantia (TRAMIL) : Différence entre versions
| Ligne 7 : | Ligne 7 : | ||
|nomcourtsuivant=''Morinda citrifolia'' | |nomcourtsuivant=''Morinda citrifolia'' | ||
}} | }} | ||
| + | [[File:Momordica charantia feuille TRAMIL.jpg|thumb]] | ||
| + | [[File:Momordica charantia fruit ouvert TRAMIL.jpg|thumb]] | ||
| + | [[File:Momordica charantia fruit vert TRAMIL.jpg|thumb]] | ||
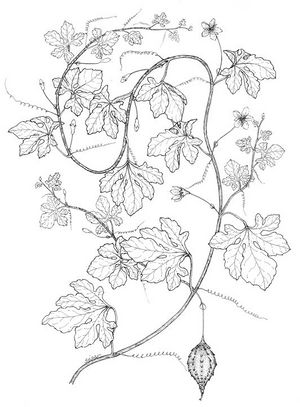
| + | [[File:Momordica charantia dessin TRAMIL.jpg|thumb]] | ||
Version actuelle en date du 7 décembre 2020 à 20:53
| |
- Nom accepté : Momordica charantia
- Voir sur la TRAMILothèque (davantage d’illustrations)
Sommaire
Noms vernaculaires significatifs TRAMIL
- Antigua : maiden blush
- Barbade : cerasee
- Costa Rica et Guatemala : sorosí
- Dominique : kokouli
- Haïti : asorosi
- Honduras : calaica
- Puerto Rico, Rép. Dominicaine et Venezuela : cundeamor
- Tobago : corailee, sorrow seed, popololo
- autres noms créoles : manjé kouli, pawoka, ponm zendyen, ti konkonb kouli
Distribution géographique
Originaire de l’Ancien Monde et naturalisée sous tous les tropiques.
Description botanique
Herbe grimpante pouvant atteindre 6 m, habituellement très ramifiée. Feuilles alternes de 4 à 12 cm, avec 5-7 lobes; lobes obtus ou mucronés, bords dentés ou crénelés. Corolle jaune, segments obtus ou émargés de 1,5 à 2 cm. Fruit ellipsoïdal, tuberculé, déhiscent, de 5 à 15 cm de diamètre, jaune à orangé, avec 3 valves; pulpe de couleur rouge; graines ellipsoïdales, aplaties, de 10 à 16 mm.
Vouchers :
- Faujour,3,BAR
- Pimentel,1111,JBSD
- García,2329,JBSD
- Girón,167,CGEH
- Delens,105,VEN
- Lagos-Witte,7,HPMHV
- Fonrose,52,SOE
- Mejía,s/n,MAPR
- Delaigue,19,NHTT
Emplois traditionnels significatifs TRAMIL
- affections cutanées sèches, démangeaisons, poux (pédiculose) : parties aériennes, écrasées et/ou en macération aqueuse, bains, friction et application locale1-10
- furoncles : parties aériennes, écrasées, bains5
- rhume : parties aériennes, décoction, voie orale11-13
- cloques sur la peau : feuille et tige, bain et cataplasme7,14
Recommandations
Selon l’information disponible :
L’emploi contre les furoncles et le rhume est classé REC sur la base de l’usage significatif traditionnel documenté par les enquêtes TRAMIL, les études de toxicité et l’information scientifique publiée.
L’emploi contre les affections cutanées sèches de la peau, les démangeaisons et les poux (pédiculose) est classé REC sur la base de l’expérience traditionnelle de l’usage documenté par son emploi significatif dans les enquêtes TRAMIL.
Toute application locale doit se conformer à des strictes mesures d’hygiène, afin d’éviter la contamination ou une infection supplémentaire.
Si l’état du patient se détériore, ou si les furoncles persistent au-delà de 5 jours, consulter un médecin.
Ne pas employer par voie orale avec une femme enceinte car susceptible de provoquer un avortement et/ou un effet tératogène.
Ne pas employer avec des femmes allaitantes, ni avec des enfants de moins de 3 ans.
Chimie
Travail TRAMIL15
Sélection phytochimique préliminaire (parties aériennes) :
| alcaloïdes | ± |
| composants phénoliques | + |
| flavonoïdes | ± |
| quinones | - |
| saponosides | + |
| stéroïdes, terpénoïdes | + |
| tanins | + |
Il existe une grande variation dans la composition chimique selon le lieu de croissance16.
Analyse proximale pour 100 g de feuille17 : calories : 44; eau : 84,6%; protéines : 5,6%; lipides : 0,6%; glucides : 7%; fibres : 1,6%; cendres : 2,2%; calcium : 288 mg; phosphore : 54 mg; fer : 5 mg; sodium : 19 mg; potassium : 510 mg; carotène : 5085 μg; thiamine : 0,13 mg; riboflavine : 0,45 mg; niacine : 1,50 mg; acide ascorbique : 170 mg.
Constituants chimiques de Momordica charantia :
| Partie de la plante | Type de constituant | Nom du constituant |
|---|---|---|
| parties aériennes | triterpènes | momordicines I, II et III18 |
| fruit | aminoacides | alanine, β-alanine, phényl-alanine, acide γ-amino-butyrique, acide glutamique, proline, tryptamine19 polypeptide p20 |
| fruit | stéroïdes | charantine, α-spinastérol, β-sitostérol, stigmastérol et dérivés |
| glucide | acide D-galacturonique21 | |
| fruit vert | saponine | diosgénine22 |
| triterpènes | momordicosides E, E-1, EX, F, F’, F-1, F-2, G, H, I, J, K, & L23 | |
| péricarpe fruit | caroténoïdes | α, β, γ carotènes et dérivés, lutéine, licopène, rubixanthine, zéaxanthine, zéinoxanthine24 |
Activités biologiques
L’extrait aqueux (décoction) de feuille in vitro n’a pas eu d’activité antifongique contre Epidermophyton floccosum, Microsporum canis, Trichophyton mentagrophytes var. algodonosa ni var. granulare25.
L’extrait aqueux de feuille séchée à des concentrations variables a démontré une forte activité insecticide contre Blatella germanica mais pas contre Oncopeltus fasciatus26.
L’extrait méthanolique de feuille séchée (2 mg/mL) a été actif in vitro, contre Corynebacterium diphteriae, Streptobacillus spp., Streptococcus spp. et Staphylococcus aureus27.
L’extrait aqueux de fruit a montré une action marquée face à Bacillus subtilis (CL = 50 mg/disque) et Candida albicans (CL = 25 mg/disque). Les extraits chloroformique, éthéré et méthanolique ont aussi été actifs, mais comparativement avec moins d’efficacité28.
L’extrait hydroalcoolique (50%) de plante entière séche a eu une action antihistaminique faible sur iléon isolé de cobaye (0,01 g/mL)29.
Toxicité
Travaux TRAMIL30-31
Le jus lyophilisé obtenu à partir de 500 g de feuille appliqué avec des compresses de gaze stérile sur la peau rasée d’un groupe de 14 lapins albinos mâles New Zealand (2-3 kg) et de 16 cobayes blancs Hantley des deux sexes, avec une observation sur 24 et 72 heures et une analyse histopathologique par biopsie, a montré un indice d’irritation primaire inférieure à 5 (non irritant ni allergisant).
Travail TRAMIL16
Le produit de la cuisson de la plante entière avec fruit vert mais sans racine, (25 g/kg) par voies orale et intrapéritonéale à la souris, n’a pas entraîné la mort. Le fruit mûr administré oralement à la souris a mis en évidence une DL50 = 3 g/kg.
L’extrait aqueux (décoction) des parties aériennes (2 doses de 25 mL/kg) par voie orale au rat Wistar femelle (150-200 g), modèle de classe aiguë toxique, n’a provoqué aucun signe de toxicité ni de mortalité en 14 jours d’observation, avec une DL50> 2000 mg/kg32.
L’extrait aqueux de parties aériennes, par voie topique, test d’irritation dermique (0,5 mL) et ophtalmiques (0,1 mL) sur le lapin New Zealand, modèle décrits par l’OEDC 404 et 405, ont été classés comme non-irritant dans les deux cas32.
L’extrait éthanolique (50%) de plante entière (10 g/kg) par voies sous-cutanée et orale à la souris, n’a pas provoqué de manifestations de toxicité générale29.
L’extrait de fruit traité à l’acétone et purifié, contenant le principe actif hypoglycémiant, administré par voie intrapéritonéale à la souris, a révélé des signes de toxicité rénale qui se sont manifestés par une augmentation des niveaux d’urée, sans effets nocifs sur le foie, le cœur ni le sang33.
L’extrait aqueux (décoction) de feuille (500 mg/kg) par voie orale au rat femelle, n’a pas eu d’effet anti-implantation. A des doses de 200 mg/kg, elle n’a pas produit d’effet abortif ni embryotoxique34.
L’extrait aqueux (décoction) de feuille fraîche (0,10 mg/ mL) in vitro a eu une activité génotoxique sur Aspergillus nidulans35.
Le jus du fruit (6 mL/kg/jour) par voie orale à la lapine, a entraîné la mort au bout de 23 jours. Parmi les femelles gravides, ce jus a provoqué 10 morts et 2 cas d’hémorragie utérine36.
L’extrait aqueux de fruit vert (5 kg/300 mL) (2 mL/jour), par voie orale à 24 rates Sprague-Dawley gestantes, aux jours 7 à 14 de la gestation, a provoqué des malformations dans 8,65% de la progéniture des animaux ayant reçu l’extrait contre 1,62% pour le groupe témoin. 31,2% de tous les descendants malformés ont présenté des malformations congénitales multiples37.
L’extrait alcoolique (95%) de fruit (1,75 g/animal/jour) par voie orale au chien mâle a provoqué une diminution dans la formation des spermatozoïdes au bout de 20 jours, avec destruction progressive et totale des vaisseaux spermatiques, destruction d’un grand nombre de différents types de cellules, sauf les cellules de Sertoli et les spermatides basales, ainsi qu’une diminution de la lumière de l’épididyme et des vases déférents au bout de 60 jours d’administration38.
L’extrait alcoolique (95%) de fruit (200 mg/kg/jour/14 jours) par voie orale au gerbille mâle, a induit une réduction significative du poids testiculaire et une interruption de la spermatogénèse, sans affecter les vaisseaux spermatiques, ni la prostate39.
L’extrait éthanolique (95%) de fruit (110 mg/kg/jour/30 jours) par voie orale au gerbille mâle, n’a pas provoqué d’effets de toxicité générale. A une dose de 150 mg/kg/ jour, il a entraîné la mort 20 à 30% des animaux avant le 30ème jour38.
L’extrait aqueux (décoction) de fruit à des doses de 500 mg/personne par voie orale, n’a pas été toxique40. L’extrait aqueux de la plante entière, (15 mL/personne/ jour) par voie orale à des femmes enceintes, a inhibé le développement du foetus41.
Deux composés présents dans la graine (α-trichosanthine, α et la β-momorcharine) auraient un effet abortif42-43.
On ne dispose d’aucune information pouvant garantir l’innocuité de ce remède administré aux enfants, aux femmes enceintes ou allaitantes.
Préparation et dosage
Contre les affections cutanées :
Laver soigneusement les parties aériennes de la plante puis les écraser. Appliquer 30 grammes (une poignée) de la matière végétale sur la peau de la zone affectée 3 fois par jour.
Contre le rhume :
Préparer une décoction avec 30 grammes de parties aériennes dans 4 tasses (1 litre) d’eau, faire bouillir pendant 5 minutes dans un récipient couvert. Laisser refroidir, filtrer et boire 1 tasse 3 fois par jour.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- CHARLES C, 1988 TRAMIL survey. Movement for Cultural Awareness MCA, Roseau, Dominica.
- WENIGER B, ROUZIER M, 1986 Enquête TRAMIL. Service Oecuménique d’Entraide SOE, Port au Prince, Haïti.
- LAGOS-WITTE S, 1988-1995 Encuestas TRAMIL. Laboratorio de Histología Vegetal y Etnobotánica, Departamento de Biología, Universidad Nacional Autónoma de Honduras UNAH, Tegucigalpa, Honduras.
- GERMOSEN-ROBINEAU L, GERONIMO M, AMPARO C, 1984 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- WENIGER B, 1987-88 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003 Encuesta TRAMIL (Zambrana, Cotuí). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
- CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003 Encuesta TRAMIL (region Este). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
- DELENS M, 1990 Encuesta TRAMIL en Barlovento, Edo. Miranda de Venezuela. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
- GIRON L, 1988 Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala.
- DELAIGUE J, 2005 TRAMIL survey. UAG & PRDI, Tobago House of Assembly, Scarborough, Tobago.
- O’REILLY A, 1992 TRAMIL survey. Chemistry & Food Technology Division, Ministry of Agriculture, Dunbars, Antigua & Barbuda.
- OCAMPO R, 1988 Encuesta TRAMIL (Costa atlántica), Instituto de Desarrollo Agrario, Universidad de Costa Rica, San José, Costa Rica.
- FAUJOUR A, MURREY D, CHELTENHAM-CORBIN B, CARRINGTON S, 2003 TRAMIL survey. IICA & UAG, Saint Thomas, Barbados.
- BENEDETTI MD, 1994 Encuesta TRAMIL. Universidad de Puerto Rico, Mayagüez, Puerto Rico.
- WENIGER B, SAVARY H, DAGUIHL R, 1984 Tri phytochimique de plantes de la liste TRAMIL. Laboratoire de chimie des substances naturelles, Faculté de médecine et de pharmacie, Université d’Etat d’Haïti, Port au Prince, Haïti.
- HERRERA J, 1990 Determinación de actividades biológicas de vegetales utilizados en medicina tradicional. Informe TRAMIL. Dep. de Farmacología, Facultad de Salud, Universidad del Valle, Cali, Colombia.
- DUKE JA, ATCHLEY AA, 1986 Handbook of proximate analysis tables of higher plants. Boca Raton, USA: CRC Press. p110.
- YASUDA M, IWAMOTO M, OKABE H, YAMAUCHI T, 1984 Structures of momordicines I, II and III, the bitter principles in the leaves and vines of Momordica charantia. Chem Pharm Bull 32(5):2044-2047.
- DHALLA NS, GUPTA KC, SASTRY MS, MALHOTRA CL, 1961 Chemical composition of the fruit of Momordica charantia. Indian J Pharmacy 23:128-130.
- KANNA B, 1976 Insulin from Momordica charantia. Patent-Japan Kokai.
- NG TB, YEUNG HW, 1984 Bioactive constituents of Cucurbitaceae plants with special emphasis on Momordica charantia and Trichosanthes kirilowii. Seoul, Korea: Proc. 5th. Symposium Medicinal Plants and Spices.
- KHANNA P, MOHAN S, 1973 Isolation and identification of diosgenin and sterols from fruits and in vitro cultures of Momordica charantia. Indian J Exp Biol 11:58-60.
- OKABE H, MIYAHARA K, YAMAGUCHI T, MIYAHARA K, KAWASAKI T, 1980 Studies on the constituents of Momordica charantia L. I: Isolation and characterization of momordicosides A and B, glycosides of a pentahydroxy-cucurbitane triterpene. Chem Pharm Bull 28(9):2753- 2762.
- RODRIGUEZ DB, RAYMUNDO LC, TUNG-CHING LEE, SIMPSON KL, CHICHESTER CO, 1976 Carotenoid pigment changes in ripening Momordica charantia fruits. Ann Bot (London) 40(3):615-624.
- CACERES A, JAUREGUI E, HERRERA D, LOGEMANN H, 1991 Plants used in Guatemala for the treatment of dermatomucosal infections. 1: Screening of 38 plant extracts for anticandidal activity. J Ethnopharmacol 33(3):277-283.
- HEAL R, ROGERS E, WALLACE RT, STARNES O, 1950 A survey of plants for insecticidal activity. Lloydia 13(2):89-162.
- HUSSAIN HSN, DEENI YY, 1991 Plants in Kano ethnomedicine; screening for antimicrobial activity and alkaloids. Int J Pharmacol 29(1):51-56.
- MANEELRT S, SATTHAMPONGSA A, 1978 Antimicrobial activity of Momordica charantia. Undergraduate special project report. Bangkok, Thailand: Mahidol University. Faculty of Pharmacy.
- MOKKHASMIT M, SAWASDIMONGKOL K, SATRAWAHA P, 1971 Study on toxicity of Thai medicinal plants. Bull Dept Med Sci 12(1/2):36- 65.
- GONZALEZ A, ALFONSO H, 1990 Evaluación de la toxicidad dérmica de Momordica charantia L., Foeniculum vulgare Mill y Cassia occidentalis L. en cobayos. Informe TRAMIL. Centro Nacional de Salud Animal, La Habana, Cuba.
- GONZALEZ A, ALFONSO H, 1990 Evaluación de la toxicidad dérmica de Momordica charantia L. y Cassia occidentalis L. en conejos. Informe TRAMIL. Centro Nacional de Salud Animal, La Habana, Cuba.
- LAGARTO A, COURET M, GUERRA I, LOPEZ R, 2008 Toxicidad aguda oral y ensayos de irritación de extractos acuoso e hidroalcohólico de (follaje) Momordica charantia L. Rev Cubana Plant Med [online] 13(3):0-0. Disponible en: http://bvs.sld.cu/revistas/pla/ vol13_3_08/pla05308.htm
- TABORA O, 1986 Estudio de toxicidad aguda en ratones de la fracción hipoglucemiante de Momordica charantia (Cucurbitaceae). Tegucigalpa, Honduras: IV Semana Científica Universidad Nacional Autónoma de Honduras UNAH.
- PRAKASH AO, MATHUR R, 1976 Screening of Indian plants for antifertility activity. Indian J Exp Biol 14(5):623-626.
- RUIZ AR, DE LA TORRE RA, ALONSO N, VILLAESCUSA A, BETANCOURT J, VIZOSO A, 1996 Screening of medicinal plants for induction of somatic segregation activity in Aspergillus nidulans. J Ethnopharmacol 52(3):123-127.
- SHARMA VN, SOGANI RK, ARORA RB, 1960 Some observations on hypoglycemic activity of Momordica charantia. Indian J Med Res 48(4):471-477.
- UCHE-NWACHI EO, MC EWEN C, 2010 Teratogenic effect of the water extract of bitter gourd (Momordica charantia) on the Sprague Dawley rats. African J of Traditional, Complementary and Alternative Medicines 7(1):24-33.
- DIXIT VP, KHANNA P, BHARGAVA SK, 1978 Effects of Momordica charantia fruit extract on the testicular function of dog. Planta Med 34(3):280-286.
- KOENTJORO-SOEHADI T, SANTA I, 1982 Perspectives of male contraception with regards to Indonesian traditional drugs. Bali, Indonesia: 2nd National Congress of Indonesian Society of Andrology.
- KHAN AH, BURNEY A, 1962 A preliminary study of the hypoglycemic properties of indigenous plants. Pakistan J Med Res 2:100-116.
- WEST M, SIDRAK G, STREET S, 1971 The anti-growth properties of extracts from Momordica charantia. West Indian Med J 20(1):25-34.
- NG T, 1988 Effects of momorcharins on ovarian response to gonadotropin induced superovulation in mice. Int J Fertil 33(2):123-128.
- YEUNG HW, LI WW, FENG Z, BARBIERI L, STIRPE F, 1988 Trichosanthin, alpha-momorcharin and beta-momorcharin: Identity of abortifacient and ribosome-inactivating protein. Int J Peptide Protein Res 31(3):265-268.