Cuscuta australis (PROTA)
Introduction |
Cuscuta australis R.Br.
- Protologue : Prodr. 491 (1810).
- Famille : Convolvulaceae
- Nombre de chromosomes : 2n = 28, 56
Synonymes
- Grammica australis (R.Br.) Hadac & Chrtek (1970).
Noms vernaculaires
- Cuscute du sud, cuscute australe (Fr).
- Australian dodder, southern dodder (En).
- Enleios, cipo chumbo (Po).
- Mlangamia (Sw).
Origine et répartition géographique
Cuscuta australis est présent dans de grandes parties de l’Afrique tropicale et subtropicale, ainsi qu’en Europe méridionale, en Asie et en Australie. En Afrique tropicale, il est répertorié depuis le Sénégal jusqu’en Ethiopie et vers le sud jusqu’en Afrique du Sud. Il se rencontre également à Madagascar.
Usages
Alors que l’usage médicinal de Cuscuta australis est très important en Asie, son utilisation en Afrique n’a été que rarement observée. Au Nigeria, la décoction de la plante entière s’utilise comme laxatif, vermifuge, astringent, et pour soigner les plaies, la rougeole et les problèmes rénaux et hépatiques. En Asie du Sud-Est, l’extrait de la plante est appliqué comme émollient, sédatif, sudorifique et tonique, et pour traiter les problèmes urinaires. En médecine traditionnelle chinoise, les graines, en combinaison avec celles de Cuscuta chinensis Lam. et parfois de Cuscuta japonica Choisy, sont appelées “tu si zi” ou “semen cuscutae”, et seraient de nature neutre avec un goût doux piquant. Elles sont associées au foie et aux reins et entrent dans des formulations pour surmonter les déficiences du yin comme du yang, dépendant de la condition du patient et des autres herbes dans la formulation. Les graines soignent un grand nombre d’affections. Elles s’utilisent comme sédatif, contre le diabète, les problèmes urinaires, l’impuissance et la stérilité, l’activité déficiente du foie, des reins et de la rate, et contre l’opacité de la cornée ; elles sont souvent utilisées en combinaison avec d’autres produits d’origine végétale.
En raison de son mode de croissance entrelacée, la plante sert en Afrique de l’Ouest comme charme d’amour ou comme épreuve d’affection. Les Yorubas au Nigeria utilisent la plante en invocation pour tenir un secret.
Production et commerce international
Les graines de Cuscuta australis et également celles de Cuscuta chinensis sont largement vendues en Asie et, à plus petite échelle, dans le monde entier. Il n’existe pas de données quantitatives sur la production et le commerce.
Propriétés
De nombreux composés, dont plusieurs flavonoïdes, ont été isolés des graines de Cuscuta australis, notamment le kaempférol et ses dérivés, l’astragaline, la quercétine et l’hypéroside. D’autres composés sont la thymidine, l’acide cafféique, le glucoside β-D-cafféique, l’acide p-coumarique, l’australiside A (un kaurène-6-O-glucoside diterpénoïde), et plusieurs acides cuscutiques (des tri-hétérosides avec l’acide jalapinolique ou l’acide convolvulinolique comme aglycone). Les terpénoïdes volatiles, observés en quantités significatives, comprennent le cinnamate, le méthyl cinnamate, la dihydro-5,6-déhydrokavaïne et l’acide myristique.
L’extrait alcoolique des tiges a augmenté la phagocytose des macrophages ainsi que l’hémolyse et la prolifération des lymphocytes jusqu’au niveau normal chez la souris souffrant de brûlures au deuxième degré couvrant 50% du corps. On a conclu que la plante pourrait servir d’immuno-renforçateur pour les mammifères. Les extraits de graines ont montré une activité modérée contre les bactéries gram-positives. Cependant, l’extrait n’avait guère d’effet sur une protéine de la surface bactérienne impliquée dans la fixation aux cellules des mammifères. Dans un essai au Nigeria, les extraits à l’hexane, au butanol et à l’éthanol 50% de la plante entière ont montré peu d’activité antibactérienne ou rien du tout. L’extrait à l’éthanol des graines a fait ressortir une cytotoxicité in vitro, et l’extrait aqueux une activité réduite de la tyrosinase.
Au Vietnam, les plantes de Cuscuta australis enfouies dans le sol des rizières ont abouti à une réduction de la croissance des mauvaises herbes.
Falsifications et succédanés
Dans le médicament chinois “tu si zi”, on utilise les graines de Cuscuta australis et de Cuscuta chinensis de façon interchangeable malgré des différences dans la composition chimique. On peut distinguer les espèces par la comparaison de la proportion quantitative de certains composés chimiques indicateurs. Les graines de Cuscuta japonica constituent également un ingrédient commun du “tu si zi”, mais n’ajouteraient pas grand-chose à ses propriétés pharmacologiques.
Description
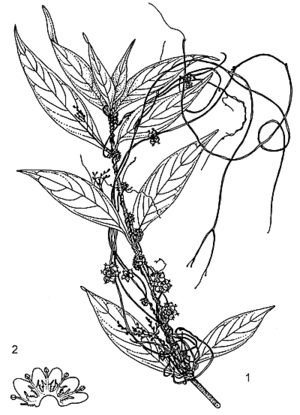
Parasite obligatoire constitué principalement de tiges, herbacé, volubile, annuel ou rarement pérenne. Racines absentes sauf chez le semis. Tiges minces, atteignant 0,5 mm de diamètre, jaunâtres ou rougeâtres, n’ayant presque pas de chlorophylle, attachées à l’hôte par des haustoria. Feuilles réduites à des écailles. Inflorescence : glomérule cymeux compact. Fleurs bisexuées, régulières, 4–5-mères ; pédicelle de 1–1,5 mm de long ; calice en coupe, aussi long que le tube de la corolle, 4–5-lobé, lobes arrondis, obtus ; corolle campanulée, de 2–3 mm de long, 4–5-lobée, lobes arrondis à obtus, blancs ou blanc crème, formant un tube court à la base, avec un verticille d’écailles frangées fines à proximité des étamines ; étamines 4–5, insérées à la gorge et alternant avec les lobes de la corolle, jusqu’à 1 mm de long ; ovaire supère, 2-loculaire, styles 2, de 0,5–1 mm de long, divergents. Fruit : capsule globuleuse déprimée, enfermée dans la corolle persistante, de 3–4 mm de diamètre, s’ouvrant de façon irrégulière ou indéhiscente, rougeâtre-brun lorsque sèche, contenant en général 4 graines. Graines ellipsoïdes à ovoïdes, atteignant 1,5 mm de long, brun rougeâtre foncé. Embryon et jeune plant filiformes, sans cotylédons.
Autres données botaniques
Le genre Cuscuta est quasi cosmopolite et comprend des plantes parasites jaunes, orange, rouges ou rarement vertes. La plus grande diversité des 100–200 espèces se trouve aux Amériques. Il est parfois considéré comme le seul genre dans la famille des Cuscutaceae, mais des recherches morphologiques aussi bien que génétiques ont montré qu’il se place correctement dans les Convolvulaceae, sous-famille Cuscuteae. Cuscuta campestris et Cuscuta reflexa Roxb., espèce plus robuste, sont les cuscutes les plus nocives en tant que mauvaises herbes au niveau mondial. En Asie, Cuscuta australis est souvent confondu avec Cuscuta chinensis, qui se distingue par son fruit, qui se fend autour de la base, et par les lobes carénés de sa corolle.
Plusieurs autres espèces de Cuscuta sont utilisées en médecine traditionnelle en Afrique tropicale.
Cuscuta campestris
Cuscuta campestris Yunck (“cuscute dorée”) est originaire de l’Amérique et s’est naturalisé dans la quasi-totalité de l’Afrique orientale et australe. Il se rencontre également en Afrique du Nord et dans les îles de l’océan Indien, et il s’est largement naturalisé en Asie. La décoction des tiges broyées de Cuscuta campestris et des feuilles fraîches d’une espèce d’Artemisia se prend pour traiter les crampes abdominales. Les activités analgésiques, antipyrétiques, anti-inflammatoires et SNC-dépresseur de l’extrait éthanolique séché des plantes entières (collectées en Egypte) ont été étudiées chez le rat et la souris. L’extrait a protégé la souris contre les contorsions induites par la benzoquinone, a montré des propriétés hypothermiques et a inhibé la formation d’œdème chez le rat traité au carraghénane. L’activité SNC-dépresseur de l’extrait semble causée par un effet sédatif.
Cuscuta reflexa
Cuscuta reflexa Roxb. (“cuscute géante”) se rencontre dans les zones tropicales et subtropicales de l’Asie et des Amériques, où il peut constituer une adventice sérieuse. On a répertorié sa présence et son usage médicinal à Maurice, où l’infusion de la plante entière s’utilise comme diurétique et contre la goutte. En Asie, la plante est importante en médecine traditionnelle, et une préparation de la plante entière est utilisée comme purgatif et aussi contre les maux de tête et la jaunisse, et pour soigner les blessures. Les composés phytochimiques isolés des tiges incluent les suivants : swarnaline, scoparone, mélanettine, cuscutine, cuscutaline, hypéroside, taxifoline, astragaline, myricétine, kaempférol, lutéoline, quercétine, reflexine et plusieurs hétérosides flavonoïdes. L’extrait méthanolique de la tige a montré une activité antibactérienne significative in vitro. La swarnaline, un dérivé de tétrahydrofurane, a fait ressortir une activité appréciable de piégeage de radicaux libres in vitro. L’extrait à l’éthanol de la plante a diminué la tension artérielle des ventricules de cobaye et a inhibé les contractions induites par l’histamine ainsi que par l’acétylcholine de l’iléon de cobaye. Les extraits ont montré des effets variables sur les muscles lisses du rat, du lapin, du cobaye, de la grenouille et du chien. L’extrait aqueux a fait ressortir une activité anti-VIH in vitro.
Croissance et développement
Bien que les plantes de Cuscuta soient capables de photosynthèse limitée, elles tirent presque toute leur énergie de la plante hôte. Le jeune plant peut survivre quelques jours sans hôte, mais il mourra s’il ne le trouve pas dans les 5 à 10 jours. Pendant leur croissance, les plantes se ré-attachent à la plante hôte de façon continue et, lorsque d’autres hôtes convenables se trouvent à sa portée, des pousses se propagent de l’un à l’autre, formant souvent un tapis dense de tiges entrelacées.
Cuscuta australis fleurit pendant la saison des pluies, mais la formation de graines est surtout élevée à la fin de la saison pluviale. La formation de graines commence en général à proximité du point d’attache initial et se propage de là vers l’extérieur ; chaque plante peut produire 1000–2000 graines.
Ecologie
Cuscuta australis est présent comme parasite sur de nombreuses dicotylédones herbacées ou arbustives. Il préfère les endroits humides, par ex. le long des cours d’eau, et se rencontre du niveau de la mer jusqu’à 2000 m d’altitude.
Multiplication et plantation
Les graines germent à la surface du sol ou tout près, au début de la saison de croissance. Un sol humide et du soleil sont requis pour la germination. La germination se produit indépendamment de la plante hôte. Les graines de Cuscuta peuvent rester viables dans le sol pendant des années, jusqu’à 50 années selon des observations. En général seulement 5% des graines germent pendant la première année après leur formation.
La graine en germination émet une tige filiforme jaunâtre sans feuilles qui s’enroule dans le sens inverse des aiguilles d’une montre autour de tout objet, y compris les plantes hôtes. Elle dépend des glucides stockés dans la graine jusqu’à ce qu’elle s’attache à un hôte qui lui convient. Lorsque le jeune plant entre en contact avec un hôte, la tige fait plusieurs tours bien serrés autour de lui et produit des haustoria sur la tige qui pénètrent dans le tissu vasculaire de l’hôte, le phloème aussi bien que le xylème. Le haustorium initial exsude de la cutine qui le colle à son hôte. Dès que la plante commence à extraire des nutriments et de l’eau de la plante hôte, le lien avec le sol se dessèche.
La graine manque de mécanismes de dispersion évidents et elle est vraisemblablement dispersée par l’homme par le déplacement de terre, des machines ou des graines de plantes cultivées infestées de cuscute. Les allées et venues d’eau pourraient jouer un rôle dans la dispersion des semences car les plantes poussent souvent à proximité des cours d’eau. La dormance est causée par un tégument qui est imperméable à l’eau ; elle peut être levée par des températures ambiantes de 35/20°C ou une scarification mécanique.
Gestion
Dans des essais en Chine, Glycine max (L.) Merr., Scutellaria baicalensis Georgi, Lespedeza davurica (Laxm.) Schindl. et Vigna radiata (L.) R.Wilczek se sont avérés être de bonnes plantes hôtes pour Cuscuta australis.
Pour lutter contre l’infestation des cultures par Cuscuta, la prévention est d’importance primaire : utilisation de graines saines et élimination de sources d’infestation dans la végétation sauvage ; l’élimination manuelle du parasite afin de prévenir la formation de graines est l’option principale pour le petit agriculteur. La séparation des graines du parasite et des plantes cultivées, par ex. du noug (Guizotia abyssinica (L.f.) Cass.), au moyen d’un équipement spécial est difficile et onéreuse. Le traitement à la chaleur sèche (100°C pendant 15 minutes) affaiblit les graines d’espèces de Cuscuta dans les graines du noug destinées aux graines pour oiseaux, mais on ne sait pas si cette méthode convient aux graines de semences. Les possibilités d’utiliser des herbicides se sont améliorées un peu depuis l’arrivée du glyphosate et du fait d’une évaluation plus intensive des herbicides de pré- et de post-levée dans un certain nombre d’autres plantes cultivées. Relativement peu de travaux de sélection ont été effectués pour arriver à des cultivars résistants. Les possibilités de lutte biologique sembleraient mériter plus d’action résolue.
Dans un essai en Chine, Cuscuta australis a été semé pour lutter contre les mauvaises herbes envahissantes telles que Alternanthera philoxeroides Griseb., Ipomoea cairica Sweet et Mikania micrantha Kunth. Les mauvaises herbes se sont avérées être beaucoup plus sensibles à Cuscuta australis que la végétation indigène. Le traitement a réduit la présence des mauvaises herbes, a ouvert la végétation et a contribué à une plus grande diversité en espèces. Les effets à long terme n’ont pas été répertoriés.
Maladies et ravageurs
Il est connu que plusieurs organismes, dont les phytoplasmes causant la maladie des “jaunes”, peuvent infester les espèces de Cuscuta, mais il n’y a pas d’information spécifique sur Cuscuta australis. Les espèces de Cuscuta sont couramment endommagées par des insectes appartenant aux genres Smicronyx (Curculionidae), Melanagromyza (Agromyzidae) et Herpystis (Tortricidae). Le potentiel de certains de ces ravageurs pour la lutte biologique est en train d’être étudié au Pakistan.
Ressources génétiques
Cuscuta australis est répandu et commun et n’est pas menacé d’érosion génétique.
Perspectives
La taxinomie de Cuscuta reste confuse bien qu’elle ait récemment progressé. Cependant, la répartition de plusieurs espèces en Afrique est toujours incertaine, tout comme l’identité de nombreux spécimens d’herbier. Cuscuta australis gardera probablement son importance en médecine, notamment en Chine. Son utilisation en médecine traditionnelle africaine continuera à être limitée. Des recherches sont nécessaires pour identifier les composés actifs et leurs modes d’action sur les maladies que la plante soigne. Cuscuta australis a été mentionné de temps en temps comme une mauvaise herbe des plantes cultivées. Il faut prendre des précautions pour qu’il ne s’établisse pas comme adventice. Un grand nombre de pays ont des lois qui exigent que les semences importées des plantes cultivées ne soient pas contaminées par des graines de Cuscuta.
Références principales
- Deroin, T., 2001. Convolvulaceae. Flore de Madagascar et des Comores, familles 133 bis et 171. Muséum National d’Histoire Naturelle, Paris, France. pp. 11–287.
- Djadja Siti Hazar Hoesen, 2003. Cuscuta australis R.Br. In: Lemmens, R.H.M.J. & Bunyapraphatsara, N. (Editors). Plant Resources of South-East Asia No 12(3). Medicinal and poisonous plants 3. Backhuys Publishers, Leiden, Netherlands. pp. 144–145.
- Du, X.M., Sun, N.Y., Nishi, M., Kawasaki, T., Guo, Y.T. & Miyahara, K., 1999. Components of the ether-insoluble resin glycoside fraction from the seed of Cuscuta australis. Journal of Natural Products 62(5): 722–725.
- Gonçalves, M.L., 1987. Convolvulaceae. In: Launert, E. (Editor). Flora Zambesiaca. Volume 8, part 1. Flora Zambesiaca Managing Committee, London, United Kingdom. pp. 9–129.
- Li, G. & Chen, Y., 1997. Chemical constituents of Cuscuta australis R. Br. Zhongguo Zhong Yao Za Zhi 22(9): 548–550, 576.
- Parker, C. & Riches, C.R., 1993. Parasitic weeds of the world: biology and control. CAB International, Wallingford, United Kingdom. 332 pp.
- Stefanovic, S., Kuzmina, M. & Costea, M., 2007. Delimitation of major lineages within Cuscuta subgenus Grammica (Convolvulaceae) using plastid and nuclear DNA sequences. American Journal of Botany 94(4): 568–589.
- Verdcourt, B., 1963. Convolvulaceae. In: Hubbard, C.E. & Milne-Redhead, E. (Editors). Flora of Tropical East Africa. Crown Agents for Oversea Governments and Administrations, London, United Kingdom. 161 pp.
- Yuncker, T.G., 1932. The genus Cuscuta. Memoirs of the Torrey Botanical Club 18(2): 126–127.
- Xiao, J., Cui, F., Ning, T. & Zhao, W, 1990. Effects of alcohol extract from Polygonatum odoratum (Mill.) Druce and Cuscuta australis R. Br. on immunological function of mice injured by burns. Zhongguo Zhong Yao Za Zhi 15(9): 557–559, 578.
Autres références
- Agha, A.M., Sattar, E.A. & Ahmed Galal, 1996. Pharmacological study of Cuscuta campestris Yuncker. Phytotherapy Research 10(2): 117–120.
- Boiteau, P., Boiteau, M. & Allorge-Boiteau, L., 1999. Dictionnaire des noms malgaches de végétaux. 4 Volumes + Index des noms scientifiques avec leurs équivalents malgaches. Editions Alzieu, Grenoble, France.
- Burkill, H.M., 1985. The useful plants of West Tropical Africa. 2nd Edition. Volume 1, Families A–D. Royal Botanic Gardens, Kew, Richmond, United Kingdom. 960 pp.
- Chang, S.-J. & Suk, K.-D., 2006. Inhibitory effects on melanin biosynthesis and tyrosinase activity, cytotoxicity in clone M-3 and antioxidant activity by Cuscuta japonica, C. australis, and C. chinensis extracts. Yakhak Hoechi 50(6): 421–428.
- Costea, M. & Tardif, F.J., 2006. The biology of Canadian weeds. 133. Cuscuta campestris Yuncker, C. gronovii Willd. ex Schult., C. umbrosa Beyr. ex Hook., C. epithymum (L.) L. and C. epilinum Weihe. Canadian Journal of Plant Science 86(1): 293–316.
- Gupta, A.K., Tandon, N. & Sharma, M. (Editors), 2008. Quality standards of Indian medicinal plants. Volume 5. Medicinal Plants Unit, Indian Council of Medical Research, New Delhi, India. 357 pp.
- Gurib-Fakim, A., Sewraj, M., Guého, J. & Dulloo, E., 1993. Medical ethnobotany of some weeds of Mauritius and Rodrigues. Journal of Ethnopharmacology 39(3): 177–185.
- He, X.H., Yang, W.Z., Ye, M., Wang,, Q. & Guo, D., 2011. Differentiation of Cuscuta chinensis and Cuscuta australis by HPLC-DAD-MS analysis and HPLC-UV quantitation. Planta Medica 77: 1950–1957.
- Khanh, T.D., Cong, L.C., Xuan, T.D., Lee, S.J., Kong, D.S. & Chung, I.M., 2008. Weed-suppressing potential of dodder (Cuscuta hygrophilae) and its phytotoxic constituents. Weed Science 56(1): 119–127.
- Lin, H.B., Lin, J.Q., Gu, H.X., Li, Y. & Lin, J.Q., 2006. Interrelation among variety, host and content of total flavonoids in dodders. Shanghai Zhongyiyao Daxue Xuebao 20(3): 66–68.
- Liu, Z.Q., Fer, A. & Lecocq, F.M., 1999. Imazaquin, a promising herbicide for control of dodder (Cuscuta spp.) in soybean (Glycine max). Weed Research 31(1): 33–40.
- Meeuse, A.D.J. & Welman, W.G., 2000. Convolvulaceae. In: Germishuizen, G. (Editor). Flora of southern Africa. Volume 28, part 1. National Botanical Institute, Pretoria, South Africa. 138 pp.
- Okiei, W., Ogunlesi, M. & Ademoye, M.A., 2009. An assessment of the antimicrobial properties of extracts of various polarities from Chasmanthera dependens, Emilia coccinea and Cuscuta australis, herbal medications for eye diseases. Journal of Applied Sciences 9(22): 4076–4080.
- Pal, D.K., Mandal, M., Senthilkumar, G.P. & Padhian, A., 2006. Antibacterial activity of Cuscuta reflexa stem and Corchorus olitorius seed. Fitoterapia 77(7–8): 589–591.
- Parker, C., 1999. Protection of crops against parasitic weeds. Crop Protection 10: 7–22.
- Schimming, T., Jenett-Siems, K., Mann, P., Tofern-Reblin, B., Milson, J., Johnson, R.W., Deroin, T., Austin, D.F. & Eich, E., 2006. Calystegines as chemotaxonomic markers in the Convolvulaceae. Phytochemistry 66(4): 469–480.
- Uddin, S.J., Shilpi, J.A., Middleton, M., Byres, M., Shoeb, M., Nahar, L. & Sarker, S.D., 2007. Swarnalin and cis -swarnalin, two new tetrahydrofuran derivatives with free radical scavenging activity, from the aerial parts of Cuscuta reflexa. Natural Product Research 21(7): 663–668.
- Ye, M., Li, Y., Yan, Y.M., Liu, H.W. & Ji, X.H., 2002. Determination of flavonoids in Semen Cuscutae by RP-HPLC. Journal of Pharmaceutical and Biomedical Analysis 28: 621–628.
- Yu, H., Liu, J., He, W.-M., Miao, S.-L. & Dong, M., 2011. Cuscuta australis restrains three exotic invasive plants and benefits native species. Biological Invasions 13: 747–756.
Afriref references
Sources de l’illustration
- van Oostroom, S.J. & Hoogland, R.D., 1951. Convolvulaceae In: van Steenis, C.G.G.J. (Editor): Flora Malesiana. Series 1, Volume 4. Noordhoff-Kolff, Djakarta, Indonesia. pp. 388–512.
Auteur(s)
- N. Nyunaï, Institut de Recherches Médicales et d’Etudes des Plantes Médicinales, B.P. 3805, Yaoundé, Cameroon
Citation correcte de cet article
Nyunaï, N., 2013. Cuscuta australis R.Br. In: Schmelzer, G.H. & Gurib-Fakim, A. (Editeurs). Prota 11(2): Medicinal plants/Plantes médicinales 2. PROTA, Wageningen, Pays Bas. Consulté le 1 avril 2025.
- Voir cette page sur la base de données Prota4U