Moringa oleifera (TRAMIL)
| |
- Nom accepté : Moringa oleifera
- Voir sur la TRAMILothèque (davantage d’illustrations)
Noms vernaculaires significatifs TRAMIL
- Haïti : benzoliv, ben olifère, bambou-bananier, graines benné
- autres noms créoles : maloko, moulen kilé
Distribution géographique
Originaire du nord-ouest de l’Inde, habituellement cultivé dans les régions tropicales du monde entier.
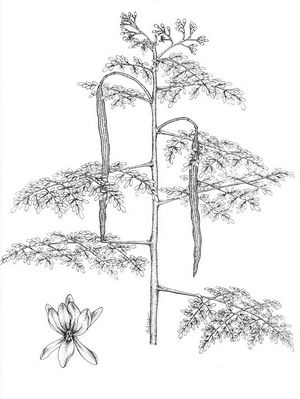
Description botanique
Arbre de 5 à 10 m de haut, tronc généralement fin et irrégulier. Feuilles alternes, pennées, oblongues, à pétiole court; nombreuses folioles opposées, à court pétiole, de 1 à 2 cm, obtuses, entières, pâles. Fleurs nombreuses, blanches, aromatiques, disposées en panicules axillaires; pétales légèrement plus longs que les sépales. Capsule linéaire, à trois angles arrondis, pendante, pouvant atteindre 45 cm de long, déhiscente, jaune cendré; graines généralement ailées, oléagineuses.
Voucher : Rouzier,129,SOE
Emplois traditionnels significatifs TRAMIL
- brûlure : graine, huile, en application locale1
Recommandations
Selon l’information disponible :
L’emploi contre les brûlures est classé REC sur la base de l’usage significatif traditionnel documenté par les enquêtes TRAMIL et les études de toxicité.
Limiter l’usage traditionnel à des brûlures superficielles (lésion épidermique), peu étendues (moins de 10% de la surface corporelle) et localisées en dehors de zones à haut risque telles que le visage, les mains, les pieds et les organes génitaux.
Toute application locale doit se conformer à de strictes mesures d’hygiène pour empêcher la contamination ou une infection supplémentaire.
Ne pas administrer pendant la grossesse, en période d’allaitement ni à des enfants de moins de 5 ans.
Chimie
Travail TRAMIL2
100 g de graine donnent jusqu’à 20 mL d’huile, du fait que la graine contient jusqu’à 21% de son poids en lipides - correspondant au concentré biologiquement actif mentionné par l’usage traditionnel.
La graine contient des lipides (21%)3: acides oléique (67,5%) et stéarique (10,5%)4; des benzénoïdes : 4-(α-L-rhamnosil-oxy)-phénylacétonitrile, 4-hydroxy- phénylacétonitrile et 4-hydroxy-phénylacétamide5-6, moringine5, niazirine7, dérivés de benzyl-carbamates; des miscellanées : niazimicine7; des composés sulfurés : benzyl-4-rhamnosil-oxy-glucosinolate8, ptérygospermine9, 4-(α-L-rhamnosil)-benzylisothiocyanate et derivés5,10-11; des stérols : dérivés de daucostérol7.
Activités biologiques
Travaux TRAMIL12-13
L’application locale sur la souris d’une pommade faite avec de l’extrait de graine a réduit le temps de guérison sur un modèle expérimental de pyodermie induite par Staphylococcus aureus, avec un comportement similaire à celui de la néomycine.
Travaux TRAMIL13-14
L’extrait aqueux (infusion 750 mg/mL) de graine, (1 g/kg) par voie intraveineuse, modèle d’œdème de patte de rat induit par la carraghénnine, a été actif comme anti-inflammatoire. Les infusions d’écorce, de feuille et de fleur séchées, ont été inactives lors du même essai. La graine, ajoutée à des réserves naturelles d’eau, a la capacité de la rendre potable pour la consommation humaine15.
La ptérygospermine a démontré une activité in vitro contre Escherichia coli et Staphylococcus aureus16-19. Ce composé a montré des effets antimycotiques contre des champignons filamenteux et antimicrobiens à large spectre contre des micro-organismes gram + et gram -, y compris Mycrococcus pyogenes var. aureus19.
Toxicité
Travail TRAMIL20
L’huile et l’émulsion (235 g de graine sèche/L d’eau), (0,5 mL/6 cm2 de peau saine et abimée/4 heures), par voie topique au lapin albinos New Zealand (3 mâles), modèles OECD n°404 et OPPTS 870.2500 EPA. Après lavage de la zone testée, la lecture de l’érythème et de l’œdème au bout de 72 heures, a montré un indice de 0,0 qui classifie l’huile et l’émulsion comme non irritants.
Travail TRAMIL21
L’huile de graine ajoutée au milieu de culture de fibroblastes humains (0,4 à 250 μg/mL exprimé en poids de graine séchée) n’a pas montré d’effet toxique.
Travail TRAMIL13
L’extrait aqueux (infusion) de graine et de feuille (5 g/kg), par voie orale à la souris, n’a pas révélé de toxicité.
La graine moulue administrée oralement au rat, pendant 6 semaines, n’a produit d’altérations histologiques sur aucun des 28 organes internes examinés22.
Les cotylédons de graine ont été toxiques pour des poissons, des protozoaires et des bactéries, en provoquant l’inhibition de l’acétylcholinestérase. Cependant, aux concentrations utilisées dans un but nutritionnel, médicinal ou sanitaire (purification de l’eau) les graines ne représentent pas un danger pour la santé humaine23.
La DL50 de la ptérygospermine, administrée oralement à la souris a été de 350-400 mg/kg24.
L’ingestion de grandes quantités de fruits peut avoir des effets toxiques25.
On attribue aux benzénoïdes dérivés de l’acide phénylacétique de graine grillée une action mutagène sur les érythrocytes polychromatiques micronucléaires (PCE) de rat et à certains d’entre eux une action génotoxique4-5.
On ne dispose pas d’information garantissant l’innocuité de son emploi médicinal sur des enfants, ni avec des femmes enceintes ou allaitantes.
Préparation et dosage
La graine de Moringa pterygosperma constitue un aliment de consommation humaine relativement répandue.
Contre les brûlures :
Laver la lésion à l’eau bouillie et au savon. Appliquer l’huile de graine, extraite à froid, sur la zone affectée; recouvrir d’une compresse ou d’un linge propre et changer 2 fois par jour.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- WENIGER B, ROUZIER M, 1986 Enquête TRAMIL. Service Oecuménique d’Entraide SOE, Port au Prince, Haïti.
- CARBALLO A, 1995 Cálculo de concentración y dosis de las drogas vegetales TRAMIL: Mensuraciones farmacognósticas y aproximaciones técnico-clínicas. Laboratorio provincial de producción de medicamentos, Sancti Spiritus, Cuba.
- DELAVEAU P, BOTTEAU P, 1980 Huiles à intérêt pharmacologique, cosmétologique et diététique. IV.- Huiles de Moringa oleifera. Plantes Médicinales and Phytothérapie 14(1):29-33.
- KHAN FW, GUL P, MALIK MN, 1975 Chemical composition of oil from Moringa oleifera. Pak J For 25(2):100- 102.
- VILLASENOR IM, FINCH P, LIM-SYLIANCO CY, DAYRIT F, 1989 Structure of a mutagen from roasted seeds of Moringa oleifera. Carcinogenesis 10(6):1085-1087.
- VILLASENOR IM, LIM-SYLIANCO CY, DAYRIT F, 1989 Mutagens from roasted seeds of Moringa oleifera. Mutat Res 224(2):209- 212.
- GUEVARA AP, VARGAS C, SAKURAI H, FUJIWARA Y, HASHIMOTO K, MAOKA T, KOZUKA M, ITO Y, TOKUDA H, NISHINO H, 1999 An antitumor promoter from Moringa oleifera Lam. Mutat Res 440(2):181-188.
- VILLASENOR IM, DAYRIT FM, LIM-SYLIANCO CY, 1990 Studies on Moringa oleifera seeds. II. Thermal degradation of roasted seeds. Philippine J Sci 119(1):33-39.
- BADGETT BL, 1964 Part one: The mustard oil glucoside from Moringa oleifera, seed. Part two: Ascorbic acid analogs with deoxy side chains. Ph.D. thesis. Rice University, Houston, Texas, USA.
- EILERT U, WOLTERS B, NAHRSTEDT A, 1981 Antibiotic principle of seeds of Moringa oleifera and Moringa stenopetala. Planta Med 42(1):55-61.
- DAYRIT FM, ALCANTAR AD, VILLASENOR IM, 1990 Studies on Moringa oleifera seeds. Part I. The antibiotic compound and its deactivation in aqueous solution. Philippine J Sci 119(1):23-32.
- CACERES A, LOPEZ S, 1991 Pharmacological properties of Moringa oleifera. 3: Effect of seed extracts in the treatment of experimental pyodermia. Fitoterapia 62(5):449-450.
- CACERES A, LOPEZ S, 1992 Informe TRAMIL sobre Moringa pterygosperma. Facultad de Ciencias Químicas y Farmacia, Universidad de San Carlos USAC, Guatemala, Guatemala.
- CACERES A, SARAVIA A, RIZZO S, ZABALA L, DE LEON E, NAVE F, 1992 Pharmacologic properties of Moringa oleifera. 2: Screening for antispasmodic, antiinflammatory and diuretic activity. J Ethnopharmacol 36(3):233-237.
- AL AZARIA JAHN S, 1981 Traditional water purification in tropical developing countries. Existing methods and potential application. Eschborn, Germany: Ed GTZ.
- KERHARO J, 1969 Un remède populaire sénégalais : le “nebreday”(Moringa oleifera Lam). Plantes médicinales et phytothérapie 3:214-219.
- RAGHUNANDANA R, GEORGE M, 1949 Investigation of plant antibiotics. III. Pterygospermin: The antibacterial principle of Moringa pterygosperma Gaernt. Indian J Med Res 37:159- 167.
- DAS B, KURUP P, NARASIMHA R, 1957 Antibiotic principle of Moringa pterygosperma VII: Antibacterial activity and chemical structure of components related to pterygospermin. Indian J Med Res 45:195-196.
- KURUP PA, NARASIMIHA RAO PL, 1954 Antibiotic principle from Moringa pterygosperma IV: Effect of addition of vitamins and aminoacids on the antibacterial activity of pterygospermin. Indian J Med Res 42:101-107.
- LOPEZ M, BOULOGNE I, BACALLAO Y, BRITO G, ACOSTA L, CABRERA H, MORON F, 2012 Recherche d’irritabilité topique sur peau saine et abîmée (selon les méthodes OECD et Acute dermal irritation) de Moringa oleifera Lam. Travail TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- WENIGER B, 1992 Activités biologiques (cytotoxicité, effet sur la croissance, effet inmunomodulateur) de drogues végétales de la Caraïbe utilisées par voie locale contre les brûlures, dans des systèmes de cellules animales et humaines en culture. Rapport TRAMIL. Faculté de Pharmacie, Université de Strasbourg, Illkirch, France.
- BERGER MR, HABS M, JAHN SA, SCHMAHL D, 1984 Toxicological assessment of seeds from Moringa oleifera and Moringa stenopetala, two highly efficient primary coagulants for domestic water treatment of tropical raw waters. East Afr Med J 61(9):712-716.
- 3 GRABOW W, SLABBERT JL, MORGAN WSG, JAHN SAA, 1985 Toxicity and mutagenicity evaluation of water coagulated with Moringa oleifera seed preparations using fish, protozoa, bacterial, coliphage, enzyme and Ames Salmonella assays. Water SA (Pretoria) 11(1):9-14.
- INGEL TH, BHIDE BV, 1951 Chemical Investigation of the gum from the drumstick plant Moringa oleifera. Curr Sci 20:107-108.
- OLIVER-BEVER B, 1986 Medicinal plants in tropical West Africa. London, England: Cambridge University Press.