Senna alata (TRAMIL)
| |
- Nom accepté : Senna alata
- Voir sur la TRAMILothèque (davantage d’illustrations)
Noms vernaculaires significatifs TRAMIL
- Guatemala : barajo
- Les Saintes : datié
- Martinique : kasyalata
- Rép. Dominicaine : guajabo
- Saint Vicent : river grava, river senna
- Tobago : wild senna, wild guava
- Venezuela : tarantantán, majagüillo
- autres noms créoles : bwa dartre, datyé, dartrier, kas pyant, zèb a dat
Distribution géographique
Originaire d’Amérique tropicale, cultivée sous les tropiques de l’Ancien Monde.
Description botanique
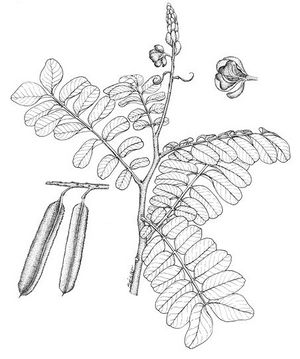
Arbuste pouvant atteindre 3 m de haut. Feuilles paripennées pouvant atteindre 70 cm de long; folioles de 6 à 14 paires, oblongs à obovés de 4 à 15 cm, émarginés. Grappes terminales avec de nombreuses fleurs de couleur jaune doré; sépales légèrement différents entre eux; 5 pétales presque égaux en forme d’ongle. Gousse aplatie linéaire avec 4 larges ailettes crénées; graine couleur café foncé à noires.
Vouchers :
- Delens,138,VEN
- Longuefosse&Nossin,36,HAVPMC
- Girón,154,CFEH
- Jiménez,3528,JBSD
- Balland,44,HVB
- Delaigue,25,NHTT
- Boulogne,TB,17,UAG
Emplois traditionnels significatifs TRAMIL
- affections cutanées : feuille, jus, application locale1,2 ; feuille, macération aqueuse, bains1-3
- boutons : feuille, macération aqueuse, bains4-5
- champignons (mycose interdigitale) : feuille, écrasée, cataplasme3
- lota (taches marron sur la peau) : feuille, infusion ou décoction, application locale2
- taches sur la peau (Pityriasis versicolor) : feuille, jus, application locale6
- teigne : feuille fraîche, écrasée avec du sel, application locale7
Recommandations
Selon l’information disponible :
L’emploi contre les affections de la peau, les taches sur la peau (Pityriasis versicolor), la teigne et les champignons (mycose interdigitale) est classé REC sur la base de l’usage significatif traditionnel documenté par les enquêtes TRAMIL, les études de toxicité, la validation et l’information scientifique publiée.
Si l’état du patient se détériore, ou si les symptômes durent plus de 5 jours, consulter un médecin.
Le traitement du lota (Pityriasis versicolor) doit durer 20 à 30 jours, les rechutes étant fréquentes si on ne suit pas les recommandations et les symptômes réapparaissent. Dans ce cas consulter un médecin.
Toute application topique doit se conformer à de strictes mesures d’hygiène, pour éviter la contamination ou une infection supplémentaire.
Ne pas employer avec des femmes enceintes ou allaitantes, ni avec des enfants de moins de 5 ans.
Chimie
La feuille contient des anthraquinones : aloé-émodine, acide chrysophanique, rhéïne8-9, dihydroxy-méthylanthraquinone; des tanins10, mais pas de saponines11.
Le fruit contient des alcaloïdes12; la feuille et la fleur ne contiennent pas de leucoanthocyanines11.
La plante contient des dérivés anthracéniques d’aloé-émodine et de rhéïne13.
Activités biologiques
Travail TRAMIL14
Les extraits aqueux (10%) et hydroalcoolique (95%) de feuille fraîche, in vitro, ont été testés sur Staphylococcus aureus, Trichophyton rubrum, Microsporum canis et Candida albicans. L’extrait aqueux n’a inhibé la croissance d’aucune souche. L’extrait hydroalcoolique a eu une action sur tous les micro-organismes étudiés, spécialement Trichophyton rubrum (100%) et Microsporum canis (83%). Le jus de plante entière in vitro a été inactif sur Epidermophyton floccosum, Microsporum gypseum, Trichophyton rubrum et Candida albicans15.
L’extrait de feuille séchée in vitro, a eu une action antibactérienne contre Staphylococcus aureus (souches sensibles et résistantes à la pénicilline) et Pseudomonas aeruginosa, isolés de sécrétions et par grattage de la peau de patients. Une autre bactérie sensible a été Streptomyces pyogenes16.
L’infusion de jeune feuille séchée in vitro (5%) a totalement inhibé la croissance de Trichophyton mentagrophytes, T. rubrum, Microsporum canis, M. gypseum et Epidermophyton floccosum inguinalis, mais elle n’a pas été active à 2,5%17. Ces mêmes extraits (2,5 et 5%) n’ont pas inhibé la croissance de Candida albicans ni de Cryptococcus neoformans18.
Les décoctions de feuille, d’écorce de la tige et de la racine (1 mL) in vitro, ont été inactives contre Epidermophyton floccosum, Microsporum gypseum, M. canis et Trichophyton mentagrophytes17.
L’extrait éthanolique sec de feuille appliqué en pommade (10% en base polyéthylène glycol) sur peau de lapin, a montré une action cicatrisante19.
L’extrait aqueux de feuille appliqué localement (en concentration de 100, 90 et 80% selon la zone corporelle) sur l’être humain atteint de Pityriasis versicolor, a éliminé le champignon Malassezia furfur cause de la maladie20.
L’extrait hydroalcoolique (50%) de feuille séchée s’est vu attribué une action antihistaminique21.
Toxicité
Travail TRAMIL22
La décoction de feuille fraîche (30%) (rendement de l’extrait 13,6 mg/mL), à une dose unique de 6154 mg de matière végétale/kg de poids corporel (volume maximum 2 mL/100 g), a été administrée par voie orale à 6 rats Sprague Dawley (3 mâles et 3 femelles). Le témoin a été réalisé avec de l’eau distillée sur un même nombre d’animaux de caractéristiques identiques. Ils ont fait l’objet d’une période d’observation de 24 heures, prolongée pendant 14 jours. Il n’a pas été constaté de mort ni de signes cliniques adverses; les études histopathologiques n’ont mis en évidence aucune lésion organique. L’extrait n’a pas montré de toxicité dans cet essai.
Travail TRAMIL23
La feuille fraîche écrasée, (0,6 g de matériel végétal en patch de 4 x 3 cm sur peau rasée durant 24 heures), par voie topique sur le rat Wistar (5 mâles et 5 femelles), selon le modèle de toxicité aiguë topique, n’a pas provoqué de mort ni d’autres signes de toxicité durant les 14 jours d’observation. L’étude hystopathologique n’a montré aucune lésion.
Travail TRAMIL24
La maceration aqueuse de feuille fraîche (à 20%), (0,6 mL, 0,12 g de materiel vegetal frais sur une surface d’à peu près 6 cm2) a été appliqué sur la peau au lapin albinos mâle New Zealand. Au bout de 4 heures, on a retiré le patch pour lecture de l’érythème et l’œdème 24, 48 et 72 heures après. Aucun signe clinique adverse n’a été remarqué, de sorte que cette application a été classée dans la catégorie non irritante.
La macération hydroalcoolique (57,28%) de feuille sèche, par voie orale à la souris Swiss albinos (poids 18 à 22 g) a montré une DL50 = 1459.32 mg/kg, selon la méthode OECD-198725.
L’extrait hydroalcoolique de feuille, (10 g de plante séchée/kg) par voie orale et sous-cutanée à la souris, n’a pas montré de signes évidents de toxicité26.
L’extrait hydroalcoolique (30%) de feuillage, administré en concentrations de 0,50 à 2,91 mg de solides totaux/mL, lors de l’essai in vitro avec Aspergillus nidulans D30 (ségrégation mytotique) et aux doses de 0,60, 1,21, 2,43 et 1313, 2625, 5250 mg/kg lors de l’expérience in vivo d’induction de micronoyaux, n’a pas montré d’activité mutagène27.
On ne dispose pas d’information permettant de garantir l’innocuité de son emploi en application locale sur des enfants, ni sur des femmes enceintes ou allaitantes.
Préparation et dosage
Contre les affections cutanées ou les boutons :
Laver soigneusement 2-3 feuilles avant d’en détacher les folioles, hacher 30 grammes de folioles et les ajouter à 4 tasses (1 litre) d’eau bouillante. Laisser reposer pendant 12 heures. Laver la zone affectée 2-3 fois par jour4.
Contre la teigne ou les champignons (mycose interdigitale) :
Nettoyer la lésion à l’eau bouillie et au savon. Laver soigneusement 1 feuille avant d’en détacher les folioles, les écraser, puis appliquer 5 grammes de matière végétale sur la peau de la zone affectée. Recouvrir avec une compresse ou un linge propre et changer 3-4 fois par jour.
Contre le lota (Pityriasis versicolor) :
Préparer une décoction ou infusion avec 30 grammes de feuilles dans 4 tasses (1 litre) d’eau. En cas de décoction bouillir 5 minutes dans un récipient couvert. Pour l’infusion, ajouter l’eau bouillante aux 30 grammes de feuilles et couvrir. Laisser refroidir, filtrer et laver la zone affectée 2-3 fois par jour pendant 20-30 jours.
On peut également laver soigneusement 1-2 feuilles avant d’en détacher les folioles, les piler dans un mortier en ajoutant éventuellement quelques gouttes d’eau bouillie, jusqu’à en extraire le jus. Filtrer la préparation avant de réaliser les lavages de la zone affectée 2-3 fois par jour pendant 20-30 jours.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- DELENS M, 1990-92 Encuesta TRAMIL. Centro al Servicio de la Acción Popular CESAP, Caracas, Venezuela.
- DELAIGUE J, 2005 TRAMIL survey. PRDI, Tobago House of Assembly, Scarborough, Tobago.
- LONGUEFOSSE JL, NOSSIN E, 1990-95 Enquête TRAMIL. Asociation pour la valorisation des plantes médicinales de la Caraïbe AVPMC, Fort de France, Martinique.
- GIRON L, 1988 Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
- BOULOGNE I, 2008 Enquête TRAMIL, Les Saintes (Terre-de-Bas), UAG, Guadeloupe (FWI).
- CASTILLO D, RODRIGUEZ S, DE LOS SANTOS C, BELEN A, 2003 Encuesta TRAMIL (región Este). Dep. de Botánica, Jardín Botánico Nacional, Santo Domingo, República Dominicana.
- BALLAND V, GLASGOW A, SPRINGER F, GAYMES G, 2004 TRAMIL survey. enda-caribbean, IICA, UAG & U.PARIS XI, Saint Vincent.
- HARRISON J, GARRO C, 1977 Study on anthraquinone derivatives from Cassia alata L. (Leguminosae). Rev Per Bioquim 1(1):31-33.
- MULCHANDANI N, HASSARAJANI S, 1975 Isolation of 1,3,8-trihydroxy-2-methylanthraquinone from Cassia alata (leaves). Phytochemistry 14:2728b.
- HAUPTMANN H, NAZARIO L, LACERDA L, 1950 Some constituents of the leaves of Cassia alata. J Am Chem Soc 72(4):1492-1495.
- RAO C, SUBHASHINI G, 1986 Saponins & leucoanthocyanins in Cassia L. Curr Sci 55(6):320-321.
- SMOLENSKI S, SILINIS H, FARNSWORTH N, 1975 Alkaloid screening. Lloydia 38(3):225-255.
- RAI M, UPADHYAY S, 1988 Screening of medicinal plants of Chindwara district against Trychophyton mentagrophytes: a causal organism of Tinea pedis. Hindustan Antibiot Bull 30(1/2):33-36.
- FIALLO M, VAZQUEZ TINEO M, 1992 Evaluación in vitro de plantas usadas en afecciones de la piel: Extractos vegetales antimicóticos y antimicrobianos. Informe TRAMIL. CIBIMA, Fac de Ciencias, Universidad Autónoma UASD, Santo Domingo, Rep. Dominicana.
- ACHARARIT C, PANYAYONG W, RUCHATAKOMUT E, 1983 Inhibitory action of some Thai herbs. Mahidol Univ Fac Pharm Bangkok, Thailand.
- BENJAMIN TV, LAMIKANRA A, 1981 Investigation of Cassia alata, a plant used in Nigeria in the treatment of skin diseases. Quart J Crude Drug Res 19(2/3):93-96.
- CACERES A, LOPEZ BR, GIRON MA, LOGEMANN H, 1991 Plants used in Guatemala for the treatment of dermatophytic infections. 1. Screening for antimycotic activity of 44 plant extracts. J Ethnopharmacol 31(3):263-276.
- FUZELLIER MC, MORTIER F, LECTARD P, 1982 Activité antifongique de Cassia alata L. Ann Pharm Fr 40(4):357-363.
- PALANICHAMY S, AMALA BHASKAR E, BAKTHAVATHSALAM R, NAGARAJAN S, 1991 Wound healing activity of Cassia alata. Fitoterapia 62(1):153-156.
- DAMODARAN S, VENKATARAMAN S, 1994 A study on the therapeutic efficacy of Cassia alata, Linn. Leaf extract against pityriasis versicolor. J Ethnopharmacol 42(1):19-23.
- MOKKHASMIT M, NGARMWATHANA W, SAWASDIMONGKOL K, PERMPHIPHAT U, 1971 Pharmacological evaluation of Thai medicinal plants (cont.). J Med Assoc Thai 54(7):490-504.
- MARTINEZ MJ, MOREJON Z, LOPEZ M, BOUCOURT E, BARCELO H, LAYNEZ A, FUENTES V, MORON F, 2003 Clases Toxicidad Aguda (CTA) de hoja fresca de Senna alata (L.) Roxb. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- MARTINEZ MJ, BETANCOURT J, LOPEZ M, MOREJON Z, FUENTES V, MORON F, 2005 Clases tóxicas agudas tópica de hoja fresca machacada de Senna alata. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- LOPEZ M, MARTINEZ MJ, MOREJON Z, BOUCOURT E, FERRADA C, FUENTES V, MORON F, 2005 Irritabilidad dérmica primaria de la maceración acuosa de hoja fresca de Senna alata (L.) Roxb. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Medicina “Dr. Salvador Allende”, La Habana, Cuba.
- LOGARTO PARRA A, SILVA YHEBRA R, GUERRA SARDINAS I, IGLESIAS BUELA L, 2001 Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
- MOKKHASMIT M, SWATDIMONGKOL K, SATRAWAHA P, 1971 Study on toxicity of Thai medicinal plants. Bull Dept Med Sci 12(2-4):36- 65.
- VIZOSO A, RAMOS A, VILLAESCUSA A, BETANCOURT J, GARCIA A, PILOTO J, DECALO M, 2002 Passiflora incarnata L. y Senna alata (L.) Roxo: Estudio toxicogenético que emplea 2 sistemas de ensayos a corto plazo. Rev Cubana Plant Med 7(1):27-31.