Ocimum gratissimum (TRAMIL)
| |
= Ocimum viride Willd.
- Nom accepté : Ocimum gratissimum
- Voir sur la TRAMILothèque (davantage d’illustrations)
Noms vernaculaires significatifs TRAMIL
- Guatemala : basen
- Haïti : atiyayo, fonbazen
- Rép. Dominicaine : albahaca vaca
- Sainte Lucie : vanne van
- autres noms créoles : bazilik, gros fonbazen, fonbazen gran fèy, benjwen, gwoboné
Distribution géographique
Originaire de l’Inde, naturalisée sous les tropiques.
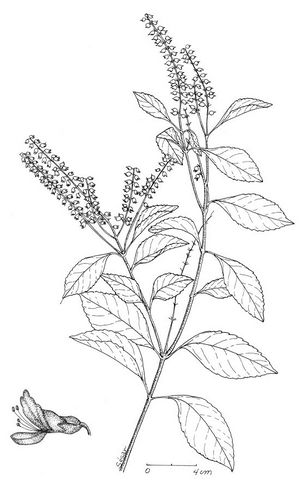
Description botanique
Arbuste pouvant atteindre 2 m, branches pubescentes ou presque glabres. Feuilles membraneuses ovées ou elliptiques, bords crénés ou en dents de scie. Inflorescences verticillées ou en grappes de 10 à 15 cm; pédicelles de 3 mm; calice de 4 à 5 mm, pubescent; corolle tubulaire blanche à rosée de 5-7 mm, pubescente; étamines tournées vers l’extérieur. Nucule subglobuleuse de 2 mm.
Vouchers :
- Rouzier,81,SOE
- Mejía,1399,JBSD
- Fuentes,4652,ROIG
- Graveson,2566,SLNH
Emplois traditionnels significatifs TRAMIL
- douleurs abdominales : feuille, décoction avec du sel, voie orale1 jus de la feuille, avec du sel, voie orale1
- flatulence : feuille, décoction ou infusion, voie orale2-3
- myasis (maladie causée par insertion cutanée de larves de mouches) : feuille fraîche, broyée, en application dans le nez4
Recommandations
Selon l’information disponible :
L’emploi contre les douleurs abdominales et les flatulences est classé REC sur la base de l’emploi significatif traditionnel documenté par les enquêtes TRAMIL, les études de validation, de toxicité et l’information scientifique publiée.
Si l’état du patient se détériore ou si les douleurs abdominales durent plus de 3 jours, consulter un médecin.
L’emploi contre le myasis est classé REC sur la base de l’expérience traditionnelle de l’usage documenté par son emploi significatif traditionnel documenté par les enquêtes TRAMIL et l’information scientifique publiée.
Toute application topique doit se conformer à de strictes mesures d’hygiène pour éviter la contamination ou une infection supplémentaire.
Ne pas employer avec des femmes enceintes ou allaitantes, ni avec des enfants de moins de 5 ans.
Chimie
Travail TRAMIL5
Sélection phytochimique préliminaire (feuille) :
| alcaloïdes | - |
| stéroïdes, terpénoïdes | + |
| quinones | - |
| flavonoïdes | + |
| saponosides | - |
| composants phénoliques | + |
| tanins | - |
La feuille contient de l’huile essentielle : β-caryophyllène (39%), germacrène D (30%), β-bourbonène, δ-cadinène, α-copahène, β-élémène, humulène, γ-muurolène6, thymol (46%), γ-terpinène (23%)7.
Cette espèce, comme les autres du même genre, contient de l’huile essentielle qui détermine bon nombre de ses propriétés pharmacologiques et toxicologiques. Il existe trois variétés chimiques, avec des variations dans le contenu de l’huile essentielle en thymol, eugénol, citral8-9, bornéol, carvacrol, caryophyllène, para-cymène, β-farnésène, linalcol, myrcène, α et β-pinène, sabinène, terpinène, terpinéol, thuyone et thymol10-12.
Activités biologiques
La fraction hydrosoluble de feuille fraîche (25%) a mis en évidence une diminution de la motilité intestinale et a inhibé les contractions induites par acétylcholine, nicotine et histamine selon le modèle d’iléon isolé de cobaye13.
L’extrait aqueux de feuille sèche (23,2 mg/kg) par voie orale à la souris, a montré une activité analgésique statistiquement significative14.
L’extrait méthanolique de feuille sèche (1,5 g/kg) par voie orale au poulet, a montré une activité antihelminthique (55,8%) contre Ascaridia galli15.
L’huile essentielle de feuille (0,1–1000 μg/mL) a provoqué un relâchement réversible dose-dépendante du tonus de base sur l’iléon isolé de cobaye et a inhibé la contraction tonique induite par KCl (60 millimoles) et acétylcholine (10 micromoles); on a déterminé une concentration inhibitrice moyenne CIM de 23,8 ± 5,2, 18,6 ± 4,0 et 70,0 ± 4,6 μg/mL16.
Un essai clinique visant à déterminer la concentration cliniquement efficace et la base la plus appropriée pour une formulation de l’huile de O. gratissimum topique pour le traitement de l’acné vulgaire, a utilisé 126 jeunes atteints de cette affection. Les échantillons étant appliqués sur une zone comprise entre 0,25 et 3 cm2 du visage après le lavage du matin et du soir pendant 4 semaines, a montré une plus grande efficacité dans la réduction des lésions plus rapide que le produit de référence17.
L’huile essentielle présente dans la feuille, en application topique pendant 15 jours sur la surface de la plaie par excision et incision réalisée sous anesthésie sur la partie postérieure du dos de lapin albinos adulte, avec observation continue pendant 6 jours, a favorisé la cicatrisation de la plaie18.
Dans un essai clinique randomisé, en parallèle et double aveugle, avec des échantillons de 10 individus, l’effet d’O. gratissimum a été mesuré dans la réduction de la plaque dentaire et de la gingivite avec l’utilisation d’un rince-bouche pendant 3 mois, et s’avère être efficace19.
On attribue au thymol un effet antihelminthique et antiseptique20.
On a constaté qu’un composé chimique isolé de la feuille dont la formule moléculaire serait C21H37O4 ou C19H35N3O3, stimule la contractibilité sur des modèles d’iléon isolé de cobaye et de côlon de rat21.
Toxicité
Travaux TRAMIL22-23
L’extrait aqueux (décoction à 30%) de feuille fraîche en dose unique (2000 et 5000 mg/kg), par voie orale à la souris Swiss OF1 (3 groupes de 10 des deux sexes) et au rat Wistar (3 femelles et 3 mâles), groupes témoins avec eau distillée, selon les modèles de toxicité aigüe classique et classes toxiques aigüe, n’a pas provoqué la mort ni de signes évidents de toxicité dans les 24 premières heures ni les 14 jours d’observation, et n’a pas mis en évidence de changement lors des études macroscopiques des organes vitaux.
Travail TRAMIL24
L’extrait hydroalcoolique (30%) de feuille sèche (750, 1000, 2000 et 3000 mg de solides totaux/kg, dose unique), par voie orale à 10 souris Swiss (5 de chaque sexe), avec un groupe non traité, un contrôle négatif (éthanol à 25%), sous observation constante les premières 24 heures puis quotidiennement durant 14 jours. L’activité motrice a diminué de façon dose-dépendante, démarche ataxique et absence de réflexe de redressement (aux doses de 1 à 3 g/kg) entre 10 et 20 minutes après l’administration. On a observé 11 morts dans les premières 24 heures, DL50 = 3,2 g/kg. Pas de mortalité les jours suivants, mais un retard dans la prise de poids. L’étude macroscopique a montré des segments de duodenum modérément hémorragiques (3 g/kg) et blanchissement rénal (1-3 g/kg). L’examen microscopique a mis en évidence des signes d’hépatotoxicité et de néphrotoxicité à toutes les doses.
Travail TRAMIL25
L’extrait hydroalcoolique (30%) de feuille sèche (3, 2,4, 1,2 et 0,6 g de solides totaux/kg), par voie orale à la souris Swiss, 3 groupes de 10 animaux des deux sexes avec un contrôle négatif (éthanol à 25%), un contrôle positif (cyclophosphamide) et un contrôle de fréquence spontanée (non traités), n’a pas entraîné de cytotoxicité médullaire, ni génotoxicité selon un modèle sur moelle osseuse.
La DL50 de l’extrait aqueux (62%) de feuille fraîche, par voie orale à la souris, a été de 2081 mg/kg13.
L’extrait éthanolique (62%) de feuille sèche par voie orale à la souris Swiss albinos (18 à 22 g) a montré une DL50 = 2081 mg/kg, selon la méthode OECD-198726.
La DL50 de l’extrait éthanolique (50%) de parties aériennes sèches, par voie orale à la souris, a été de 2,5 g/kg27. La DL50 de l’extrait hydroalcoolique (50%) par voie intrapéritonéale à la souris, a été de 1 g/kg28.
L’extrait fluide (30%) des parties aériennes n’a pas montré d’activité génotoxique au cours de l’essai in vivo d’induction de micronoyaux sur moelle osseuse de souris29.
On ne dispose pas d’information garantissant l’innocuité de son emploi médicinal avec des enfants, ni avec des femmes enceintes ou allaitantes.
Préparation et dosage
Les feuilles d’Ocimum gratissimum constituent un condiment de consommation humaine relativement répandu.
Contre les douleurs abdominales ou les flatulences :
Préparer une décoction ou une infusion avec 7 grammes de feuilles dans 1 tasse (1/4 litre) d’eau. Pour la décoction, faire bouillir 5 minutes dans un récipient couvert (avec éventuellement une pincée de sel).
Pour l’infusion, verser l’eau bouillante sur les feuilles, couvrir et laisser reposer 5 minutes. Laisser refroidir, filtrer et boire 1 tasse 3 fois par jour.
Contre le myasis :
Laver correctement la feuille et l’écraser, en quantité suffisante pour la placer à l’intérieur du nez, préalablement lavé avec de l’eau bouillie, en forme de bouchon, à appliquer 4 fois jour4.
Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- WENIGER B, 1987-88 Encuesta TRAMIL. enda-caribe, Santo Domingo, Rep. Dominicana.
- WENIGER B, ROUZIER M, 1986 Enquête TRAMIL. Service Oecuménique d’Entraide SOE, Port au Prince, Haïti.
- JEAN-PIERRE L, 1988 TRAMIL survey. St. Lucia national herbarium, Castries, St Lucia.
- GIRON L, 1988 Encuesta TRAMIL (Costa atlántica). Centro Mesoamericano de Tecnología CEMAT, Guatemala, Guatemala.
- WENIGER B, SAVARY H, DAGUIHL R, 1984 Tri phytochimique de plantes de la liste TRAMIL. Laboratoire de chimie des substances naturelles, Faculté de Médecine et de Pharmacie, Université d’Etat d’Haïti, Port au Prince, Haïti.
- ZAMUREENKO VA, TOKAREVA VY, KLYUEV NA, KARPOVA TI, GRANDBERG TI, 1981 Identification of sesquiterpene hydrocarbons of essential oil from Ocimum gratissimum L. Izv Timiryazevsk S-Kh Akad 1981(4):153-155.
- NTEZURUBANZA L, SCHEFFER JJC, BAERHEIM-SVENDSEN A, 1987 Composition of the essential oil of Ocimum gratissimum grown in Rwanda. Planta Med 53(5):421-423.
- ARCTANDER S, 1960 Perfume and flavor materials of natural origin. Elizabeth, USA: Stephen Arctander.
- HEGNAUER R, 1973 Chemotaxonomy der Pflanzen. Basel, Schweiz: Birkhauser Verlag. 6:882.
- MAIA JGS, RAMOS LS, LUZ AIR, DA SILVA ML, ZOGHBI MG, 1988 Uncommon Brazilian essential oils of the Labiatae and Compositae. In: Flavors and fragrance: a world perspective, Proceedings of the 10th International Congress of Essential Oils. Lawrence BM, Mookherjee BD, Willis BJ, Eds. New York, USA: Elsevier Sci Publ. pp:177-188.
- JANSSEN AM, SCHEFFER JJC, NTEZURUBANZA L, SVENDSEN AB, 1989 Antimicrobial activities of some Ocimum species grown in Rwanda. J Ethnopharmacol 26(1):57-63.
- NIGAM M, KHOSLA MK, BRADU BL, TANDON N, 1988 Hydration of terpene fraction of “clocimum” oil and isolation of pure myrcene. Parfume Kosmet 69(5):285-286.
- OFFIAH VN, CHIKWENDU UA, 1999 Antidiarrhoeal effects of Ocimum gratissimum leaf extract in experimental animals. J. Ethnopharmacol 68(1-3):327-330.
- AZIBA PI, BASS D, ELEGBE Y, 1999 Pharmacological investigation of Ocimum gratissimum in rodents. Phytother Res 13(5):427-429.
- NJOKU CJ, ASUZU IU, 1998 The anthelmintic effects of the leaf extract of Ocimum gratissimum (L.). Phytomedicine 5(6):485-488.
- MADEIRA SV, MATOS FJ, LEAL-CARDOSO JH, CRIDDLE DN, 2002 Relaxant effects of the essential oil of Ocimum gratissimum on isolated ileum of the guinea pig. J Ethnopharmacol 81(1):1-4.
- ORAFIDIYA LO, AGBANI EO, OYEDELE AO, BABALOLA OO, ONAYEMI O, 2002 Preliminary clinical tests on topical preparations of Ocimum gratissimum Linn. leaf essential oil for the treatment of acne vulgaris. Clinical Drug Investigation 22(5):313-319.
- ORAFIDIYA LO, AGBANI EO, ABEREOJE OA, AWE T, ABUDU A, FAKOYA FA, 2003 An investigation into the wound-healing properties of essential oil of Ocimum gratissimum Linn. J Wound Care 12(9):331-334.
- PEREIRA SL, DE OLIVEIRA JW, ANGELO KK, DA COSTA AM, COSTA F, 2011 Clinical effect of a mouth rinse containing Ocimum gratissimum on plaque and gingivitis control. J Contemp Dent Pract 12(5):350-355.
- BUDAVARI S (Ed.), 2001 The Merck index: an encyclopedia of chemical, drugs, and biologicals. 30th ed. White House Station, New Jersey, USA: Merck & Co., Inc. p1676.
- ONAJOBI FD, 1986 Smooth muscle contracting lipid-soluble principles in chromatographic actions of Ocimum gratissimum.x J Ethnopharmacol 18(1):3-11.
- GUERRA MJ, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2002 Toxicidad aguda (DL50) de decocción de hojas frescas de Ocimum gratissimum L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”. La Habana, Cuba.
- GUERRA MJ, LOPEZ M, BOUCOURT E, FUENTES V, MORON F, 2002 Clases toxicas agudas de decocción (30%) de hojas frescas de Ocimum gratissimum L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”. La Habana, Cuba.
- GUERRA MJ, LOPEZ M, BOUCOURT E, FUENTES V, 2002 Toxicidad aguda (DL50) de extracto fluido 30% de hojas secas de Ocimum gratissimum L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”. La Habana, Cuba.
- GUERRA MJ, LOPEZ M, BOUCOURT E, FUENTES V, 2002 Genotoxicidad in vivo: ensayo de micronúcleos en médula ósea de extracto fluido 30% de hojas secas de Ocimum gratisimum L. Informe TRAMIL. Laboratorio Central de Farmacología. Facultad de Medicina “Dr. Salvador Allende”, La Habana, Cuba.
- LOGARTO A, SILVA R, GUERRA I, IGLESIAS L, 2001 Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine 8(5):395-400.
- LOGARTO A, TILLAN J, VEGA R, GONZALEZ YC, 1999 Toxicidad aguda oral de extractos hidroalcohólicos de plantas medicinales. Rev Cubana Planta Med 4(1):26-28.
- DHAWAN BN, PATNAIK GK, RASTOGI RP, SINGH KK, TANDON JS, 1977 Screening of Indian plants for biological activity. VI. Indian J Exp Biol 15(3):208-219.
- PILOTO J, VIZOSO A, RAMOS A, GARCIA A, REMIGIO A, VEGA Y, GONZALEZ ML, RODRIGUEZ C, CARBALLO C, 2009 Plantas medicinales. Diez años de evaluaciones toxicogenéticas en el CIDEM. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 8(5):428-434.