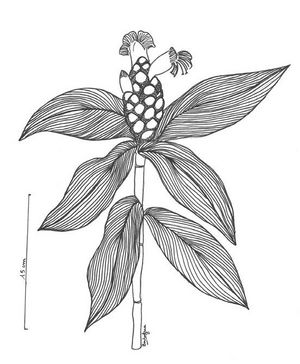
Costus pictus (TRAMIL)
| |
= Costus mexicanus Liebm. ex Petersen
- Nom accepté : Costus pictus
- Voir sur la TRAMILothèque (davantage d’illustrations)
Noms vernaculaires significatifs TRAMIL
- Cuba : caña mexicana
Distribution géographique
Native d’Amérique Centrale, distribuée du Mexique au Costa Rica.
Description botanique
Herbe pouvant atteindre 4 m de haut. Feuilles engainantes autour de la tige, disposées en spirale et laissant une cicatrice sur la tige après leurs chutes, étroites, elliptiques de 10 à 25 cm de long et 2,5 à 6 cm de large, glabres ou légèrement pubescentes sur la face supérieure, glabres à densément pubescentes sur la face inférieure. Inflorescence globuleuse à ovoïde de 3 à 8 cm de long et 3 à 4 cm de large, aux pétales jaunes à rouges et glabres. Fruit en forme de capsule subglobuleuse pouvant atteindre 15 mm de diamètre.
Voucher : Fuentes,4756,ROIG
Emplois traditionnels significatifs TRAMIL
- maux de reins (calculs rénaux, colique néphrétique) : tige (“caña”) et feuille, décoction, voie orale1 ; feuille fraîche, décoction, voie orale2 ; feuille fraîche, macération aqueuse, voie orale2
Recommandations
Selon l’information disponible :
L’emploi contre les maux de reins (colique néphrétique) est classé dans la catégorie REC sur la base de l’emploi significatif traditionnel documenté par les enquêtes TRAMIL, les études de toxicité, la validation et l’information scientifique publiée.
Si l’état du patient se détériore, ou si les symptômes durent plus de 3 jours, consulter un médecin.
L’infection ou les calculs rénaux étant dangereux pour la santé, il est recommandé de consulter un médecin au préalable. L’usage de cette médication doit être considéré comme complémentaire du traitement médical, sauf contre-indication.
Éviter son ingestion en cas de diabète3 et d’hypertension4. La feuille et la tige peuvent interagir avec les traitements correspondant.
Ne pas employer avec des femmes enceintes, allaitantes, ni avec des enfants.
Chimie
Travail TRAMIL5
L’extrait aqueux (décoction 30%) de feuille et tige fraîches par tamisage phytochimique, a montré la présence de :
| flavonoïdes | ± |
| composés phénoliques | + |
| composés lactoniques et coumarines | + |
| saponines | + |
| sucres réducteurs | + |
| triterpènes et stéroïdes | - |
| alcaloïdes | - |
| quinones | - |
| anthocyanidines et leucoanthocyanidines | - |
| aminoacides | - |
Les extraits aqueux, hydroalcoolique (50%) et alcoolique de feuille sèche, par tamisage phytochimique et identifications qualitatives, a montré la présence de :
| Extrait | aqueux | hydroalcoolique | alcoolique |
|---|---|---|---|
| triterpènes et/ou stéroïdes | ++ | ++ | ++ |
| phénols et/ou tanins | ++ | ++ | + |
| sucres (Molish) | ++ | +++ | + |
| sucres réducteurs (Fehling) | - | - | - |
| protéines et aminoacides | +++ | ++ | ++ |
| flavonoïdes | ++ | + | ± |
L’analyse chromatographique gazeuse de l’extrait de saponines de feuille a montré la présence de : acide hexadécanoïque, stéarique, oléique, heptadécanoïque, tétradécanoïque, pentadécanoïque et béhénique; phytol; octacosane et dérivés; tridécanone; tétraméthylheptadecan- 4-olide5.
La feuille contient du méthyle tétracosanoate de méthyle6.
Activités biologiques
Travail TRAMIL4
L’extrait aqueux (décoction 30%) de feuille sèche (200, 400 et 800 mg de solides totaux/kg), par voie orale au rat Wistar mâle (200-250 g), 10 animaux/groupe, modèle de diurèse, avec groupe témoin positif (furosemide, 20 mg/kg) et témoin négatif (NaCl, 0,9%), a montré une action diurétique significative dose-dépendante avec augmentation significative des niveaux de sodium et potassium. Les volumes d’urine excrété ont été mesurés au bout de ½, 1, 2, 3, 4, 5 et 6 heures ainsi que les concentrations des électrolytes (Na+ et K+) dans l’urine totale collectée.
Travail TRAMIL7
L’extrait aqueux (décoction 30%) de feuille et tige fraîches, (0,2 mL d’extrait/mL), in vitro selon le modèle de l’urètre isolé de lapin Nouvelle Zélande mâle, 10 animaux, stimulé par le chlorure de potassium 4 M (0,08 mM/L), a diminué significativement les contractions induites par le KCl.
Travaux TRAMIL8
L’extrait aqueux (décoction 30%) de feuille et tige fraîches (7, 14 et 35 mg de solides totaux/kg), 1 et 5 g/kg par voie orale à la souris Swiss mâle, 10 animaux par groupe, une heure avant l’administration d’acide acétique (0,9%, 0,1 mL/10 g) par voie intrapéritonéale selon le modèle d’activité nociceptive périphérique, le groupe témoin ayant reçu de l’eau distillée, a montré une diminution significative dose dépendante de la réponse nociceptive (nombre de contorsions/15 minutes).
Dans les mêmes conditions et selon le modèle d’activité nociceptive centrale induite par immersion du tiers distal de la queue dans de l’eau à 55°C, la dose de 5 g/kg a montré une diminution significative de la réponse nociceptive (temps de retrait de la queue).
Travail TRAMIL9
L’extrait aqueux (décoction 30%) de feuille et tige fraîches (7, 14, 35 et 70 mg de solides totaux/kg/24 h/durant 4 jours), par voie orale à 10 rats Wistar mâles (150-200 g), le groupe témoin recevant de l’indométacine (5 mg/kg) dans les mêmes conditions, modèle d’inflammation induite par le coton (50 mg) subcutané, n’a pas modifié significativement la réponse inflammatoire.
Toxicité
Travail TRAMIL10
L’extrait aqueux (décoction 50%) de feuille et tige fraîches (rendement 0,84 g de solides totaux/100 mL), dose unique, volume maximum 2,0 mL/100 g par voie orale au rat Wistar (3 mâles et 3 femelles), le groupe témoin ayant reçu de l’eau distillée, selon le modèle de classes toxiques aigües, observés constamment pendant 24 heures, n’a provoqué ni mort ni signes évidents de toxicité durant les 14 jours consécutifs d’observation; la nécropsie est restée négative pour tous les organes.
Travail TRAMIL11
L’extrait aqueux (décoction 50%) de tige fraîche, dose moyenne de 869,67 mg/kg/j/5 jours, par voie orale au rat Wistar (5 mâles et 5 femelles), le groupe témoin recevant de l’eau distillée, modèle de toxicité à doses répétées, observés constamment pendant 24 heures, n’a provoqué ni mort ni signes évidents de toxicité durant les 14 jours consécutifs d’observation; la nécropsie est restée négative pour tous les organes.
L’extrait méthanolique de plante entière fraîche (3 kg matériel végétal/ 20 L de méthanol 90%), (1 mL de extrait/25 g aux doses de 0,1, 0,2, 0,5 et 1 g/kg) par voie orale à la souris Swiss des deux sexes, 3 animaux par groupe, le groupe témoin recevant de l’eau distillée (1 mL/25 g), modèle de toxicité aigüe, n’a provoqué ni mort ni signes évidents de toxicité. Les animaux ont été observés continuellement les 6 premières heures, puis toutes les 24 heures durant 15 jours12.
Le même extrait (100 et 200 mg/kg/jour/3 mois), par voie orale au rat Sprague Dawley (250-300 g), 3 mâles et 3 femelles par groupe, modèle de toxicité aigüe, avec suivi hebdomadaire du poids corporel et prises de sang au début et à la fin de l’expérimentation (bilan hématologique et biochimique complet), n’a montré aucune altération lors de ces bilans et de l’étude histologique des organes internes et de l’évaluation du contenu en glycogène du tissu hépatique effectués au bout de 3 mois12.
On ne dispose d’aucune information pouvant garantir l’innocuité de ce remède administré aux enfants, aux femmes enceintes ou allaitantes.
Préparation et dosage
Contre maux de reins (calculs rénaux, colique néphrétique) :
Préparer une décoction avec 50 grammes de feuille et/ou de tige découpée dans 8 tasses (2 litres) d’eau, faire bouillir 10 minutes dans un récipient couvert. Laisser refroidir, filtrer et boire 1 tasse 6 à 8 fois pas jour. Toute préparation médicinale doit être conservée au froid et utilisée dans les 24 heures.
Références
- CARBALLO A, 1990 Encuesta TRAMIL. Centro de investigación de fitoterapia y medicina tradicional de Topes de Collantes, Trinidad, Cuba.
- MOREJON Z, LOPEZ M, GARCIA MJ, BOUCOURT E, VICTORIA M, FUENTES V, MORON F, BOULOGNE I, ROBINEAU L, 2009 Encuesta TRAMIL preliminar a grupos de vecinos en los municipios 10 de Octubre, Lisa, Marianao, Habana del Este (Cojímar) en la Ciudad de la Habana. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana, Ciudad de La Habana, Cuba.
- GIREESH G, THOMAS SK, JOSEPH B, PAULOSE CS, 2009 Antihyperglycemic and insulin secretory activity of Costus pictus leaf extract in streptozotocin induced diabetic rats and in in vitro pancreatic islet culture. J Ethnopharmacol 123(3):470-474.
- PEREZ M, SUEIRO M, BOFFIL M, MORON F, MONTEAGUDO E, LORENZO G, 2010 Evaluación de la actividad diurética de una decocción de hojas secas de Costus pictus D. Don. (caña mexicana) en ratas. Informe TRAMIL. Laboratorio Central de Farmacología, Universidad de Ciencias Médicas de La Habana y Unidad de Toxicología Experimental (UTEX), Universidad de Ciencias Médicas de Villa Clara, Cuba.
- MOREJON Z, CABRERA H, VICTORIA MC, MORON F, ROBINEAU L, MENDEZ G, FUENTES V, 2009 Tamizaje fitoquímico de dos extractos de Costus pictus D. Don. Trabajo TRAMIL. Laboratorio Central de Farmacología. Universidad de Ciencias Médicas de la Habana, Cuba.
- SHILPA K, SANGEETHA KN, MUTHUSAMY VS, SUJATHA S, LAKSHMI BS, 2009 Probing key targets in insulin signaling and adipogenesis using a methanolic extract of Costus pictus and its bioactive molecule, methyl tetracosanoate. Biotechnol Lett 31(12):1837-1841.
- MORON FJ, VICTORIA MC, MOREJON Z. ROBINEAU L, BACALLAO Y, FUENTES V, 2009 Acción de la decocción de hojas y tallos frescos de Costus pictus D. Don. (caña mexicana) sobre uréter aislado de conejo estimulado con KCl 4 M. Informe TRAMIL. Laboratorio Central de Farmacología. Universidad de Ciencias Médicas de La Habana, Cuba.
- MORON F, VICTORIA MC, LOPEZ M, ROBINEAU L, MOREJON Z, BOUCOURT E, FUENTES V, 2007 Actividad analgésica de la decocción de hojas y tallos frescos de Costus pictus L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- MORON FJ, GARCIA AI, VICTORIA MC, MOREJON Z, LOPEZ M, ROBINEAU L, BACALLAO Y, FUENTES V, 2009 Acción antiinflamatoria de la decocción de hojas y tallos frescos de Costus pictus D. Don (caña mexicana) en el granuloma inducido por algodón en ratas. Trabajo TRAMIL. Laboratorio Central de Farmacología. Universidad de Ciencias Médicas de La Habana, Cuba.
- MARTINEZ MJ, LOPEZ M, ROBINEAU L, MOREJON Z, BOUCOURT E, FUENTES V, MORON F, 2007 Clases tóxicas agudas (CTA) de decocción 50% de hojas y tallos frescos de Costus pictus L. Informe TRAMIL. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas “Dr. Salvador Allende”, La Habana, Cuba.
- LOPEZ M, MARTINEZ MJ, MOREJON Z, BACALLAO Y, FUENTES V, 2008 Toxicidad aguda oral a dosis repetidas de decocción al 50% de tallo fresco de Costus pictus G. Don. Informe TRAMIL. Facultad de Ciencias Médicas “Dr. Salvador Allende”, Laboratorio Central de Farmacología, C. Habana, Cuba.
- MERINA B, ANTONY B, SANTHAKUMARI G, SHEEBA V, 2008 Toxicity studies of the herb Costus pictus D. Don. R&D Laboratory, Arjuna Natural Extracts Ltd., P.B No. 126, Bank Road, Alwaye – 683 101; www.pharmainfo.net/reviews/toxicity (2feb2008)